
| A. | 0.1mol•L-1氨水中,c(OH-)<c(NH4+) | |
| B. | 10mL 0.02mol•L-1HCl溶液与10mL 0.02mol•L-1Ba(OH)2溶液充分混合,c(Cl-)>c(Ba2+)>c(OH-)=c(H+) | |
| C. | 将0.1mol•L-1CH3COONa和0.1mol•L-1NH4Cl等体积混合后的溶液中,c(H+)+c(CH3COOH)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol•L-1某二元弱酸碱性NaHA溶液中,c(H+)+c(H2A)═c(A2-)+c(OH-) |
分析 A.根据氨水中的电荷守恒判断;
B.反应后溶质为等浓度的氯化钡和氢氧化钡,溶液呈碱性;
C.醋酸铵溶液为中性溶液,醋酸根离子与铵根离子的水解程度相等,则c(CH3COOH)=c(NH3•H2O)、c(H+)=c(OH-);
D.根据NaHA溶液中的质子守恒进行判断.
解答 解:A.0.1mol•L-1氨水中,根据电荷守恒可知:c(OH-)=c(NH4+)+c(H+),则c(OH-)>c(NH4+),故A错误;
B.10ml0.02mol/L的HCl溶液中含有氯化氢0.0002mol,10ml0.02mol/L的Ba(OH)2溶液中含有氢氧化钡0.0002mol,反应后溶质为等浓度的氯化钡和氢氧化钡,混合液中氯离子和钡离子浓度相等,则c(Cl-)=c(Ba2+),由于氢氧根离子来自水的电离和氢氧化钡的电离,则c(OH-)>c(Cl-)=c(Ba2+),溶液中离子浓度大小为:c(OH-)>c(Cl-)=c(Ba2+)>c(H+),故B错误;
C.由于醋酸铵溶液为中性溶液,则醋酸根离子与铵根离子的水解程度相等,则c(CH3COOH)=c(NH3•H2O)、c(H+)=c(OH-),溶液中离子浓度关系为:c(H+)+c(CH3COOH)=c(NH3•H2O)+c(OH-),故C错误;
D.0.1mol•L-1某二元弱酸碱性NaHA溶液中,根据质子守恒可得:c(H+)+c(H2A)═c(A2-)+c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答根据,注意掌握电荷守恒、物料守恒、质子守恒及盐的水解原理在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | (CH3)3CCH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)2CHCH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mo1SO2和2mol O2 | B. | 4mol SO2、2mo1 O2和2mol SO3 | ||
| C. | 4mol SO2和4 mo1 O2 | D. | 6mo1 SO2和4 mo1 O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2$\frac{\underline{\;500℃\;}}{V_{2}O_{5}}$2SO3△H=-196.6 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ | |
| D. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体的熔点比金属晶体的低 | |
| B. | 在晶体中只要有阳离子,一定有阴离子 | |
| C. | 在SiO2晶体中,Si原子与Si-O键数目比为1:2 | |
| D. | 离子化合物中可能含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应停止 | B. | N2、H2、NH3的浓度均相等 | ||
| C. | N2、H2、NH3的浓度保持不变 | D. | N2的消耗速率等于NH3的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 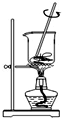 将海带灼烧成灰 | B. | 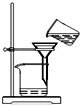 过滤得含I-溶液 | ||
| C. |  萃取后分层碘的CCl4溶液 | D. | 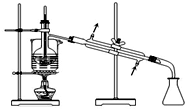 分离碘并回收CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
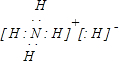 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com