
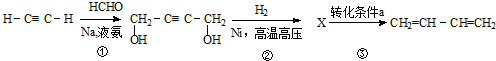
| A. | X的结构简式为:HOCH2CH=CHCH2OH | |
| B. | 反应③的转化条件a为:NaOH醇溶液,加热 | |
| C. | 1,3-丁二烯与等物质的量的Br2发生加成,所得产物可能有2种 | |
| D. | ①、②、③的反应类型依次为取代反应、加成反应、消去反应 |
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | (4)(1)(3)(6)(3) | B. | (4)(3)(1)(6)(5)(3) | C. | (1)(3)(2)(6)(3) | D. | (4)(1)(3)(5)(6)(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 125g CuSO4•5H2O晶体中含有Cu2+离子数一定小于0.5NA | |
| B. | 常温下,pH=3的醋酸溶液中,醋酸分子的数目一定大于10-3NA | |
| C. | 由S6、S7、S8组成的硫蒸气6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 3.6g C与3.36L O2一定条件下恰好完全反应,生成CO分子数一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式为: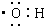 | |
| B. | 甘氨酸的结构简式为:C2H5NO2 | |
| C. | 间羟基苯甲酸的结构简式为: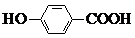 | |
| D. | Na2S在溶液中水解的离子方程式为:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

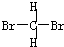 和
和 E.甲烷和庚烷F.
E.甲烷和庚烷F.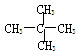 和C(CH)3
和C(CH)3 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
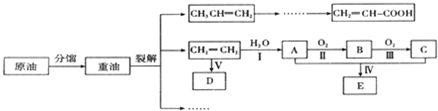
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
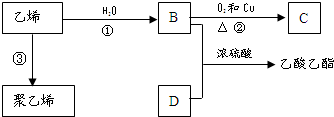 已知乙烯能发生如图转化
已知乙烯能发生如图转化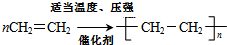 ,反应类型加聚反应.
,反应类型加聚反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com