
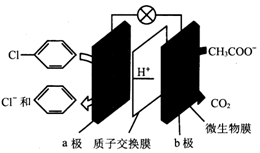
| A. | 该装置能将化学能转化为电能 | |
| B. | a极发生还原反应 | |
| C. | b极电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+ | |
| D. | 每除去1mol氯苯,电路中转移1mol电子 |
分析 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知a为正极,正极有氢离子参与反应,电极反应式为 +2e-+H+═
+2e-+H+═ +Cl-,b极为负极,电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+,以此解答该题.
+Cl-,b极为负极,电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+,以此解答该题.
解答 解:A.原电池将化学能转化为电能,故A正确;
B.根据原电池中氢离子的移动方向可知a为正极,发生还原反应,故B正确;
C.b极为负极,电极反应为CH3COO-+2H2O-8e-═2CO2↑+7H+,故C正确;
D.据正极有氢离子参与反应,电极反应式为 +2e-+H+═
+2e-+H+═ +Cl-,则每除去1mol氯苯,电路中转移2mol电子,故D错误;
+Cl-,则每除去1mol氯苯,电路中转移2mol电子,故D错误;
故选:D.
点评 本题涉及原电池的工作原理以及应用的考查,为高频考点,侧重于学生的分析能力的考查,注意知识的迁移和应用是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 蒸发、过滤、蒸馏、分液 | B. | 蒸馏、分液、蒸发、过滤 | ||
| C. | 蒸馏、过滤、蒸发、分液 | D. | 蒸发、分液、蒸馏、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
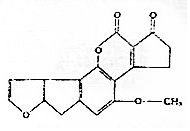 黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )
黄曲霉素AFTB1,其结构简式如图所示.它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性.下列说法正确的是( )| A. | 黄曲霉素分子中所有的原子均共面 | |
| B. | 黄曲霉素分子中含有2个手性碳原子 | |
| C. | 黄曲霉素可以发生取代,加成,氧化反应 | |
| D. | 1mol黄曲霉素最多能与7molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率与Ag+浓度有关 | B. | Ag2+也是该反应的催化剂 | ||
| C. | Ag+能降低该反应的活化能和焓变 | D. | v(Cr3+)=v(S2O82-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子排布为1s22s22p43s2的原子处于激发态 | |
| B. | 某元素质量数51,中子数28,其基态原子中未成对电子数为1 | |
| C. | 若某基态原子的外围电子排布为4d15s2,该元素原子核外有5个电子层 | |
| D. | BF3中B原子sp2杂化,为平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 5:1 | C. | 1:1 | D. | 1:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com