
| A. | 实验式CH2 | B. | 结构简式CH2=CHCH3 | ||
| C. | 球棍模型  | D. | 聚合后的结构简式 |
分析 A.实验式是指最简式;
B.结构简式是指把分子中各原子连接方式表示出来的式子,通常只适用于以分子形式存在的纯净物;
C.是一种空间填充模型,用来表现化学分子的三维空间分布,在此作图方式中,线代表共价键,可连结以球型表示的原子中心;
D.聚丙烯为碳碳双键相互加成形成的高分子化合物.
解答 解:A.丙烯分子式为C3H6,实验式 CH2 ,故A正确;
B.丙烯含有一个官能团碳碳双键,结构简式为:CH2=CHCH3,故B正确;
C.丙烯为含碳碳双键的烯烃,球棍模型 为: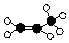 ,故C正确;
,故C正确;
D.聚丙烯为高分子化合物,聚丙烯是由丙烯不饱和的碳原子相互加成得到的,其结构简式为 ,故D错误;
,故D错误;
故选D.
点评 本题考查了化学用语的分析,主要是实验式、结构简式、球棍模型等知识的判断,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.
消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式 | B. | H2O2的电子式 | C. | HCI的电子式 | D. | Cl-的结构示意图  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解食盐水制备金属钠 | B. | 加热分解Cu2O制备金属铜 | ||
| C. | 用A12O3与CO热还原法制备单质铝 | D. | 湿法炼铜是用铁和硫酸铜溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S2O7 | B. | H2S2O8 | C. | H2S3O10 | D. | H2S4O13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4+H2$→_{△}^{催化剂}$ CHCl3+HCl | B. | 2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO | ||
| C. |  +HNO3$→_{50℃-60℃}^{浓H_{2}SO_{4}}$+H2O+ +HNO3$→_{50℃-60℃}^{浓H_{2}SO_{4}}$+H2O+ | D. |  +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 1mol化合物X最多能与8mol H2反应 | |
| D. | 在酸性条忤下水解,水解产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com