
| A. | 根据物质能否导电,可以将化合物分为电解质和非电解质 | |
| B. | 根据氧化物中是否含有金属元素,可以将氧化物分为碱性氧化物和酸性氧化物 | |
| C. | 根据组成元素的种类,将纯净物分为单质和化合物 | |
| D. | 根据分散系的稳定性大小,可以将分散系分为胶体、浊液和溶液 |
分析 A、根据化合物的水溶液或熔融态能否导电判断电解质和非电解质;
B、酸性氧化物、碱性氧化物和两性氧化物的分类是依据氧化物的性质进行分类;
C、同种元素组成的纯净物为单质,不同种元素组成的纯净物为化合物;
D、分散系的分类依据是分散质微粒直径大小分析判断.
解答 解:A、根据化合物的水溶液或熔融态能否导电将化合物分为电解质和非电解质,故A错误;
B、依据氧化物性质把氧化为分为酸性氧化物、碱性氧化物和两性氧化物,故B错误;
C、同种元素组成的纯净物为单质,不同种元素组成的纯净物为化合物,根据组成元素的种类将纯净物分为单质和化合物,故C正确;
D、根据分散系分散质微粒直径将分散系分为溶液、胶体和浊液,故D错误;
故选C.
点评 本题考查电解质非电解质、分散系、氧化物等分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 6.72L CO | B. | 6.6gCO2 | C. | 8gSO3 | D. | 9.8gH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol•L-1H2C2O4溶液 | 30 mL 0.01 mol•L-1kMnO4溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4溶液 | 30 mL 0.01 mol•L-1KMnO4溶液 |
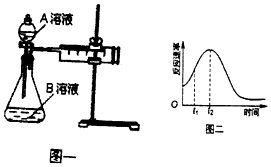
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该矿泉水越鲜越好 | |
| B. | 该矿泉水宜存放一段时间再用 | |
| C. | 鲜用和存放一段使用对人体危害是一样的 | |
| D. | 越深层开采矿泉水,污染程度越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com