
分析 (1)工业制硝酸总产物为硝酸和水,目的产物为硝酸,根据原子利用率=$\frac{目标生成物的总质量}{参加反应物质的总质量}$×100%计算解答;
(2)NOx与NaOH溶液反应生成亚硝酸钠、硝酸钠与水,令NOx、NaOH系数都为1,配平方程式,根据方程式求生成的NaNO3和NaNO2的物质的量之比.
解答 解:(1)有工业制硝酸的总化学方程为:NH3+2O2═HNO3+H2O,可知制硝酸的总产物为硝酸和水,目的产物为硝酸,原子利用率最大值=$\frac{63}{17+2×32}$×100%≈77.8%.
故答案为:77.8%;
(2)尾气NOx用足量NaOH溶液吸收,发生反应生成亚硝酸钠、硝酸钠与水,令NOx、NaOH系数都为1,配平后方程式为2NOx+2NaOH=(2x-3)NaNO3+(5-2x)NaNO2+H2O,生成的NaNO3和NaNO2的物质的量之比为:(2x-3):(5-2x),
故答案为:(2x-3):(5-2x).
点评 本题考查含氮的化合物的性质以及绿色化学知识,注意发生反应的量之间的关系,绿色化学又称原子经济化学,就是尽量让反应物中的原子的利用率达到最大值,题目难度不大.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 负极发生的反应为Fe-2e-=Fe3+ | |
| B. | 正极发生的反应为2H2O+O2+4e-=4OH- | |
| C. | Cl-向负极迁移 | |
| D. | 铁锈是Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023 | |
| B. | 反应MgCl2(s)═Mg(s)+Cl2(g)的△H<0、△S>0 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| D. | 0.1 mol•L-1 Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HS${o}_{3}^{-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
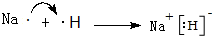 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+] | |
| B. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 向氨水中逐滴加入盐酸至溶液的pH=7,则混合液中:[NH4+]=[Cl-] | |
| D. | pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 | |
| B. | 为防止寨卡病毒传播,可用漂粉精或双氧水对环境进行消毒 | |
| C. | 大力开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| D. | 硅酸钠溶液应存放在配有玻璃塞的广口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amolD,同时生成2amolC | |
| B. | 3v(B)正=2v(C)逆 | |
| C. | 容器内的压强不再变化 | |
| D. | C(B);C(C);C(D)=3;2;1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:
)和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式: ,该反应属于取代反应.
,该反应属于取代反应.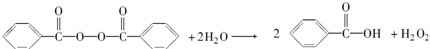 .苯甲酸的同分异构体中,属于酯类的有
.苯甲酸的同分异构体中,属于酯类的有 ,属于酚类的有3.(写结构简式)
,属于酚类的有3.(写结构简式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com