
| A. | 只有① | B. | 只有①③④ | C. | 只有①②③ | D. | ①②③④ |
分析 ①石油分馏时把温度计放在蒸馏烧瓶的支管口处;
②饱和碳酸钠溶液能够除去乙醇、乙酸,且降低了乙酸乙酯的溶解度;
③酸性高锰酸钾溶液都能够与乙炔、乙烯反应;
④制取溴苯必须用液溴,不能用溴水.
解答 解:①石油分馏时把温度计不能插入受热的液体中,应该放在蒸馏烧瓶的支管口处,故①错误;
②碳酸钠溶液能够吸收乙醇、消耗乙酸,且乙酸乙酯在饱和碳酸钠溶液中的溶解度减小,可用饱和碳酸钠溶液除去乙酸乙酯中混有的乙醇、乙酸,故②正确;
③乙烯和乙炔都能够与酸性高锰酸钾溶液反应,无法用酸性高锰酸钾溶液除去乙炔中的乙烯,故③错误;
④将苯和液溴混合后加入铁粉制取溴苯,不能用溴水,故④错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及石油分馏、物质检验与除杂等知识,明确常见元素及其化合物性质为解答关键,注意熟练掌握常见化学实验基本操作方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
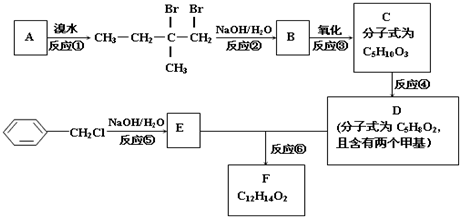
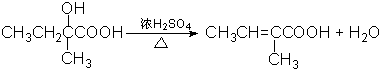 ;
;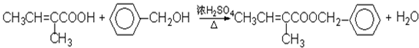 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 具有水果香味的中性物质A可以发生下列变化:
具有水果香味的中性物质A可以发生下列变化:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
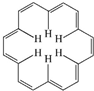 早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图所示.有关它的说法正确的是( )
早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图所示.有关它的说法正确的是( )| A. | [18]-轮烯分子中所有原子不可能处于同一平面 | |
| B. | [18]-轮烯是芳香族化合物 | |
| C. | 1 mol[18]-轮烯最多可与9 mol氢气发生加成反应生成环烷烃 | |
| D. | [18]-轮烯与乙烯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com