
| ���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7 K2=5.6��10-11 |
| 30xg+46yg |
| (x+y)mol |
| 16g |
| 16g/mol |
| 3 |
| 4 |
| 1 |
| 2 |
| 346.8kJ |
| 0.2mol |


 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ɫ��������Һ�У�Cr2O72-��I-��Na+��K+ |
| B��pHΪ0����Һ��Cu2+��Na+��Mg2+��NO3- |
| C��ˮ���������c��H+��=10-13mol/L����Һ��K+��HCO3-��Br-��Ba2+ |
| D���Ѻ�Fe3+����Һ��K+��SCN-��NO3-��Al3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ڳ��³�ѹ�£�14 gN2���еķ�����Ϊ0.5NA |
| B��50 mL1 mol/L��Na2SO4��Һ�к�Na+��ΪNA |
| C����״���£�22.4 L H2��O2�Ļ����������������ΪNA |
| D��24 g Mg�������ַ�Ӧת�Ƶ�����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
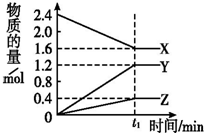 ij�¶��£���2L�ܱ�������3����̬���ʼ���з�Ӧ��X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1 minʱ����ƽ�⣬��ͼ��ʾ��
ij�¶��£���2L�ܱ�������3����̬���ʼ���з�Ӧ��X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1 minʱ����ƽ�⣬��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij�¶��£���2L������3�����ʼ���з�Ӧ��X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1minʱ����ƽ�⣬��ͼ��ʾ��
ij�¶��£���2L������3�����ʼ���з�Ӧ��X��Y��Z�����ʵ�����ʱ��ı仯������ͼ����Ӧ��t1minʱ����ƽ�⣬��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
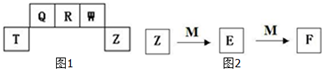 ������Ԫ��T��Q��R��W��Z��Ԫ�����ڱ��е�λ����ͼ1��ʾ������T��������������������������ȣ�������ػ�ѧ����ش��������⣺
������Ԫ��T��Q��R��W��Z��Ԫ�����ڱ��е�λ����ͼ1��ʾ������T��������������������������ȣ�������ػ�ѧ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A��E2 |
| B��E2-E1 |
| C��E3-E2 |
| D��E3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com