
��ѡ����16�֣���ҵ��ˮ�г�����һ������Cr2O72����CrO42�������ǻ�����༰��̬ϵͳ�����ܴ���������д��������õĴ������������֡�
����1����ԭ������
�÷��Ĺ�������Ϊ��CrO42��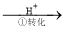 Cr2O72��
Cr2O72��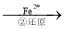 Cr3+
Cr3+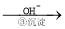 Cr(OH)3��
Cr(OH)3��
���еڢٲ�����ƽ�⣺2CrO42��(��ɫ)+2H��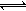 Cr2O72��(��ɫ)+H2O
Cr2O72��(��ɫ)+H2O
��1����ƽ����ϵ��pH=2������Һ�� ɫ��
��2����˵���ڢٲ���Ӧ��ƽ��״̬���� ��
A��Cr2O72����CrO42����Ũ����ͬ
B��2v (Cr2O72��)= v (CrO42��)
C����Һ����ɫ����
��3���ڢڲ��У���ԭ1molCr2O72�����ӣ���Ҫ mol��FeSO4 7H2O��
7H2O��
��4���ڢ۲����ɵ�Cr(OH)3����Һ�д��ڳ����ܽ�ƽ��,��д��������ܽ�ƽ�ⷽ��ʽ
�����£�Cr(OH)3���ܶȻ�Ksp=[Cr3+]��[OH?]3=10?32��Ҫʹc(Cr3+)����10?5mol/L����Һ��pHӦ���� ��
����2����ⷨ
�÷���Fe���缫��⺬Cr2O72�������Է�ˮ�����ŵ����У�������������ҺpH���ߣ�����Cr(OH)3������
��5����Fe���缫��ԭ���� ��
��������������ҺpH���ߵ�ԭ����(�õ缫��Ӧ����) ����Һ��ͬʱ���ɵij������� ��
(1)�� (2)c (3)6 (4) Cr(OH)3(s)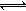 Cr3+(aq)+3OH?(aq) 5
Cr3+(aq)+3OH?(aq) 5
(5)������ӦΪFe��2e����Fe2+���ṩ��ԭ��Fe2+
��6)2H++2e����H2�� Fe(OH)3
��������
���������(1)pH=2����Һ�����ԣ������Գ�ɫ����2������ƽ���־��Ũ�Ȳ��䡢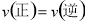 ������Һ����ɫ����ﵽƽ�⣻��3�����ݵ�ʧ�����غ㣬Cr��+6�۱�Ϊ+3�ۣ�1molCr2O72������Ҫ��6mol���ӣ�1mol��FeSO4
������Һ����ɫ����ﵽƽ�⣻��3�����ݵ�ʧ�����غ㣬Cr��+6�۱�Ϊ+3�ۣ�1molCr2O72������Ҫ��6mol���ӣ�1mol��FeSO4 7H2O ��ΪFe3+����ʧ����1mol��������Ҫ6mol FeSO4
7H2O ��ΪFe3+����ʧ����1mol��������Ҫ6mol FeSO4 7H2O����4��Cr(OH)3����Һ�г����ܽ�ƽ�ⷽ��ʽCr(OH)3(s)
7H2O����4��Cr(OH)3����Һ�г����ܽ�ƽ�ⷽ��ʽCr(OH)3(s)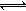 Cr3+(aq)+3OH?(aq) ��
Cr3+(aq)+3OH?(aq) ��
10?5��[OH?]3=10?32��[OH?]=10-9������PHӦΪ5����5��Fe������������������Ӧ������Fe2+��Fe2+��ԭCr2O72����������������ԭ��Ӧ��2H++2e����H2�������������ӣ�����PH����Fe2+������ΪFe3+���Ի�����Fe(OH)3������
���㣺���⿼��������ԭ�������ܽ�ƽ�⡢�绯ѧ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��ˮ�и�����ѧ�ڵ��Ĵμ�⻯ѧ�Ծ��������棩 ���ͣ������
��12�֣���ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����ǻ�����༰��̬ϵͳ�����ܴ���������д��������õĴ������������֡�
����1����ԭ������
�÷��Ĺ�������Ϊ
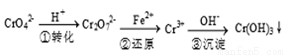
���еڢٲ���������ƽ�⣺2CrO42- (��ɫ) +2H+  Cr2O72-(��ɫ) +H2O
Cr2O72-(��ɫ) +H2O
��1����ƽ����ϵ��pH=2������Һ�� ɫ��
��2����˵���ڢٲ���Ӧ��ƽ��״̬���� ��
A��Cr2O72-��CrO42-��Ũ����ͬ
B.2V(Cr2O72-)=V(CrO42-)
C����Һ����ɫ����
��3���ڢ۲����ɵ�Cr(OH)3����Һ�д������³����ܽ�ƽ��
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3=c (Cr3+)?c3(OH-)=10-32
Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3=c (Cr3+)?c3(OH-)=10-32
�����£�Ҫʹc(Cr3+)����10-5mol/L����Һ��pHӦ����__________��
����2��ⷨ��
�÷���Fe���缫��⺬Cr2O72-�����Է�ˮ�����ŵ��Ľ��У�������������ҺpH���ߣ�����Cr(OH)3������
��4����Fe���缫��ԭ��Ϊ ��
��5��������������ҺpH���ߵ�ԭ���õ缫��Ӧʽ���ͣ� ����Һ��ͬʱ���ɵij������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ�����и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����Լ���ŵ�������ȷ����
A����������Һ�������ɫ�Լ�ƿ��
B�������Ʊ�����CCl4�У��Ƶ��ܶ�С��CCl4��
C��Ũ�����װ�˰�װ��Ӧ������ͼ��ʾ�ı�ʶ
D������������Һ�����ڴ��������IJ���ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡӢ��ѧУ��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
CO��H2�������3 g������������ȼ�պ���150��ʱ���������ͨ��������Na2O2��Na2O2���ص�����Ϊ
A��1.5 g B��3 g C��6 g D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡӢ��ѧУ��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ȥNa2CO3 ����������NaHCO3����ѷ�����
A�������������� B������NaOH��Һ
C������ D�������Һ��ͨ��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ������
��4�֣���25mL 0��1 mol��L-1��NaOH��Һ����μ���0��2 mol��L-1��CH3COOH��Һ����ҺpH�仯������ͼ��ʾ��
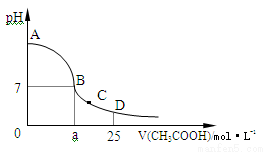
��1��B����Һ�����ԣ����˾ݴ���Ϊ����B��ʱNaOH��Һ��CH3COOH��Һǡ����ȫ��Ӧ�����ֿ����Ƿ���ȷ�� ����ǡ������������ȷ�������ǡ����ȫ��Ӧ�ĵ����� ���AB������BC����CD���������ڡ�
��2����D��ʱ����Һ��c(CH3COO-)+c(CH3COOH) 2c(Na+)(�>������<����=��)��
��3����C�㣬��Һ������Ũ���ɴ�С��˳��Ϊ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����и���������ָ����Һ��һ���ܴ����������
A��0. 1mol��L-1NaOH ��Һ�� K����Na����SO42�� ��CO32��
B��0.1mol��L-1Na2CO3 ��Һ�� Al3+��Ba2+��NO3�� ��Cl��
C��0.1mol��L-1FeCl3 ��Һ�� K����NH4+ ��I����SCN��
D����ˮ�����c(H��)=1��0��10-9 mol?L?1��Һ�� Ca2����Na����HCO3����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ�ڵ����ο��Ի�ѧ�Ծ��������棩 ���ͣ������
��12�֣�Fe2(SO4)3��һ����Ҫ�Ļ���ԭ�ϣ�����������⣺
��1��Fe2(SO4)3��Һ�в��ܴ������ڵ������� ��
��Ag+ ��Cu2�� ��NO3- ��H�� ��Fe(OH)3����
��2��Fe2(SO4)3��Һ��Ba(OH)2��Һ��Ӧ�����ӷ���ʽΪ ��
��3��1LFe2(SO4)3��Һ�У�m(Fe3+)= a g ����ȡ��0.25L����Һ��c(SO42��)= ��
��4���٣�ijͬѧ������0.05 mol��L��1��Fe2(SO4)3��Һ�����ø�Fe2(SO4)3��Һ��12g 10%��NaOH��Һǡ����ȫ��Ӧ�����ͬѧ��ȡ______ mLFe2(SO4)3��Һ��
�ڣ�����ͬѧ�������Ƶ�Fe2(SO4)3��Һ�뺬12g 10%��NaOH��Һǡ����ȫ��Ӧʱ��������������Ȣ�����������ƫС������ܵ�ԭ����___ ___��
A��������Һʱ��δϴ���ձ�
B��������Һʱ��δ��ȴ�����£�����������
C��������Һʱ����������ƿ�̶���
D����ˮʱ�����̶��ߣ��ý�ͷ�ι�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�ڵ����ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ů����������Ҫԭ�������ۡ�����̿��ˮ��ʳ�εȣ����л���̿��ԭ��صĵ缫֮һ��ʳ�ε�����������ˮ�γɵ������Һ�������йء�ů��������˵���������
A����ů������ʹ��ǰҪ�ܷⱣ�棬ʹ֮���������
B����ů�������ų���������������������Ӧʱ������
C������̿��������ԭ����������������۵�����
D������̿���ս�ת��Ϊ������̼
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com