
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K= ![]() .有关该平衡体系的说法正确的是( )
.有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
【答案】A
【解析】解:A.由平衡常数可知Z、W为反应物,Y为生成物,X应为固体或纯液体,反应前后气体的物质的量不变,但由于X为固体或液体,得到平衡时,气体的总质量不变,则平均相对分子质量保持不变,可判断得到平衡状态,故A正确; B.增大压强虽然平衡不移动,但由于体积变小,因此各物质的浓度均增大,故B错误;
C.由于反应的热效应未知,则升高温度不能确定平衡移动的方向,故C错误;
D.X未计入平衡常数中,X量的多少不影响平衡状态,故D错误.
故选:A.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示: 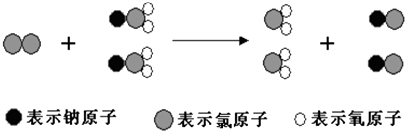
下列有关该反应的叙述中正确的是( )
A.该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl
B.该反应是应是复分解反应
C.反应中Cl2既是氧化剂,又是还原剂
D.NaClO2和ClO2中Cl元素的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.稀硫酸与氢氧化钡溶液反应:H++OH﹣═H2O
B.碳酸氢钠溶液与盐酸反应:CO ![]() +2H+═CO2↑+H2O
+2H+═CO2↑+H2O
C.铝与氢氧化钠溶液反应:2Al+2OH﹣+2H2O═2AlO ![]() +3H2↑
+3H2↑
D.铁与氯化铁溶液反应:Fe3+Fe═2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的存储是氢能应用的主要瓶颈,2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子.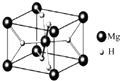
(1)C60晶体易溶于苯、CS2 , 说明C60是 分子(选填:“极性”、“非极性”);
(2)1mol C60分子中,含有σ键数目为 .
(3)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度agcm﹣3 , 则晶胞的体积为 cm3[用a、NA表示阿伏加德罗常数].
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a和b分成甲、乙两室.标准状况下,在乙室中充入0.6molHCl,甲室中充入NH3、H2的混合气体,静止时活塞位置下图.已知甲、乙两室中气体的质量之差为10.9g.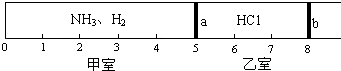
请回答下列问题:
(1)甲室中气体的物质的量为mol.
(2)甲室中气体的质量为g.
(3)甲室中NH3、H2的物质的量之比为 , 质量比为 .
(4)经过查资料知道HCl+NH3=NH4Cl(NH4Cl常温下是固体),如果将板a去掉,当HCl与NH3完全反应后,活塞b将静置于刻度“”处(填数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是 , 潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式 .
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+O2(g)2SO3(g),过程中测定的部分数据见表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=;
②此温度下该反应的化学平衡常数K= ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10﹣36;H2S:K a1=1.3×10﹣7 , K a2=7.1×10﹣15 ,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.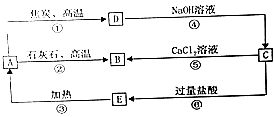
(1)写出各物质的化学式:A;C .
(2)写出反应①的化学方程式该反应中氧化剂与还原剂的物质的量之比为 .
(3)写出反应④的离子方程式: .
(4)写出反应⑤的离子方程式 .
(5)H2CO3的酸性强于E的酸性,请用离子方程式予以证明: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B.将湿润的红色石蕊试纸放入集有氨气的集气瓶中,试纸由红色变为蓝色,说明氨水呈碱性
C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D.
将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的直接氧化产物为NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com