
短周期主族元素X、Y、Z、W原子序数依次增大,X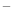 与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是
与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是
A.微粒半径:X<X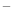
B.简单氢化物的稳定性:Z比W的强
C.W的氧化物的水化物的酸性一定比Z的强
D.最外层电子数由大到小的顺序为:Z、 W、Y
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2015-2016学年宁夏银川第九中学高二上学期期中测试化学试卷(解析版) 题型:选择题
对可逆反应4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.化学反应速率关系是:2υ正(NH3) = 3υ正(H2O)
B.达到化学平衡时,4υ正(O2) = 5υ逆(NO)
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上学期期中测试化学试卷(解析版) 题型:填空题
按要求写出有关氧化还原反应的化学方程式.
(1)是化合反应,也是氧化还原反应_________.
(2)是分解反应,也是氧化还原反应_________.
(3)有金属单质Ag生成的置换反应__________.
(4)不属于四种基本反应类型的氧化还原反应__________.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
把下列四种 X的溶液,分别加入盛有10mL 2mol·L-1盐酸的烧杯中,并均加水稀释到50mL,此时X和
X的溶液,分别加入盛有10mL 2mol·L-1盐酸的烧杯中,并均加水稀释到50mL,此时X和 盐酸缓和地进行反应,其中反应速率最大的是
盐酸缓和地进行反应,其中反应速率最大的是
A.20mL 2mol·L-1 B.10mL 5mol·L-1
C.20mL 3mol·L-1 D.10mL 3mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届福建省四地六校高三上学期第二次联考化学试卷(解析版) 题型:选择题
某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①少量澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓H2SO4( 无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝).(假设每一次吸收均完全).对该混和气体成分判断正确的是
A.一定没有CO2,肯定有H2
B.一定有CO、CO2和水蒸气
C.可能有CO2、NH3和水蒸气
D.一定有H2、CO2和HCl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上学期期中测试化学试卷(解析版) 题型:选择题
常温时,以下4种溶液pH最小的是
A.0.02mol/L醋酸溶液与等体积的水混合
B.0.02mol/L醋酸与0.02mol/LNaOH溶液等体积混合液
C.0.03mol/L醋酸与0.01mol/LNaOH溶液等体积混合液
D.pH = 2的盐酸与pH = 12的NaOH溶液等体积混合液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上期中联考化学试卷(解析版) 题型:填空题
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应: 甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJ•mol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJ•mol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJ•mol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJ•mol-1
(1)分析二甲醚合成反应(iV)对于CO转化率的影响 。
(2)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响: 。
(3)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是: 。

查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是 。(填写编号)
①粗盐提纯
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)实验室欲配置450mL 0.25mol·L-1 NaOH溶液:
①配制时除需用胶头滴管、托盘天平(带砝码)、玻璃棒、药匙外,还必需用到的仪器是 。
②通过计算,应用托盘天平称取 NaOH固体,若将物码放反,则所配制溶液物质的量浓度 。(填“偏大”、“偏小”或“不变”)
③定容时,仰视液面,则所配溶液物质的量浓度 。(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省太原市高一上学期阶段测化学试卷(解析版) 题型:填空题
钙元素是人体必须的常量元素,所有细胞都需要钙元素。正常人体血液中钙离子浓度为2.2x10-3mol/L~2.71x10-3mol/L.。请回答下列问题。
(1)血液中钙离子浓度高于或等于2.75x10-3mol/L 称为高血钙症。一个成年人全身血液总量约为4L,则高血钙病人血液中的钙离子至少为 mol;
(2)如果以“g/L”表示,正常人体血液中钙离子浓度的最小值为 g/L;
(3)草酸钙(CaC2O4)难溶于水,是人体内结石的主要成分,其摩尔质量为 g/mol;豆腐中含有较多钙盐(如硫酸钙),硫酸钙的电离方程式是 ;菠菜、洋葱中含有丰富的草酸钠(Na2C2O4),硫酸钙与草酸钠反应的化学方程式是 ,由此说明生活中上述食物正确的食用方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com