
| A、原溶液的浓度为0.1mol/L |
| B、反应后溶液中c(Fe3+)=0.1mol/L |
| C、原溶液中c(Br?)=0.4mol/L |
| D、反应后溶液中c(Fe3+)=c(Fe2+) |
| 2 |
| 15 |
| 2 |
| 15 |
| 2 |
| 15 |
| v |
| vm |
| 1.12L |
| 22.4L/mol |
| 2 |
| 15 |
| 2 |
| 15 |
| 2 |
| 15 |
| 0.15mol |
| 1L |
| 0.1mol |
| 1L |
| 0.15mol×2 |
| 1L |
| 0.1mol |
| 1L |
| 0.05mol |
| 1L |


科目:高中化学 来源: 题型:
| A、过氧化钠可作航天员和潜水员的供氧剂 |
| B、干冰和碘化银均可用于人工降雨 |
| C、近年来出现的城市雾霾与汽车尾气的排放无关 |
| D、高铁车厢大部分材料采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配位化合物中必定存在配位键 |
| B、配位化合物中只有配位键 |
| C、配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用 |
| D、[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12C、14C、C60互为同分异构体 |
| B、由同种元素组成的物质一定是纯净物 |
| C、金属氧化物存在酸性氧化物 |
| D、N2O3的水溶液能导电,说明N2O3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
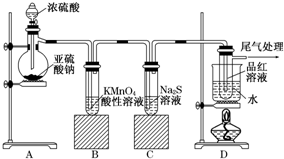 某化学兴趣小组为探究SO2的性质,按图所示装置进行实验.
某化学兴趣小组为探究SO2的性质,按图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用锌与稀硝酸制备H2 |
| B、CaCO3中混有少量NaHCO3,可用加热的方法除去 |
| C、可用蒸馏水来区分NO2和溴蒸气 |
| D、用相互滴加的方法来鉴别AlCl3和氨水两瓶试剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
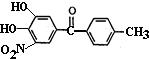 )是一种治疗帕金森氏病的药物.
)是一种治疗帕金森氏病的药物.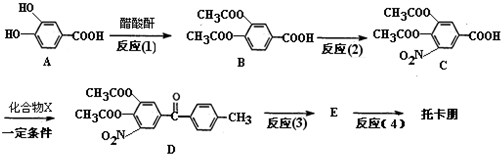
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是K2CO3 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 | 说明常温下 Ksp(BaCO3)<Ksp(BaSO4) |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
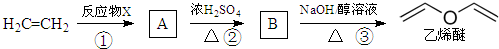
| A、X可能为Br2 |
| B、X可能为HO-Cl |
| C、乙烯醚易溶于水 |
| D、①②③反应类型依次为加成、取代和消去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com