
| A. | 无法确定 | B. | 前者快 | C. | 后者快 | D. | 一样快 |
科目:高中化学 来源: 题型:选择题
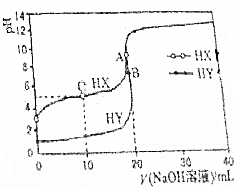 25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )| A. | 根据滴定曲线,可得Ka(CH3COOH)≈10-5 | |
| B. | pH=7时,滴定醋酸溶液消耗的V(NaOH溶液)<20mL | |
| C. | C点溶液:c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当V(NaOH溶液)=20mL时,A点水电离出c(H+)大于B点水电离出的c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若含X的混合物为溴水,可通过方案Ⅰ进行分离,加入试剂为CCl4溶液,充分振荡后液体分层,下层为X的CCl4溶液 | |
| B. | 若含X的混合物为BaSO4、BaSO3的混合物,可通过方案Ⅱ进行分离得到X,加入试剂为稀硝酸,X为BaSO4 | |
| C. | 若含X的混合物为乙醇和乙酸乙酯的混合物,可通过方案Ⅰ进行分离,加入试剂为饱和NaOH溶液,残留液中含有乙酸钠 | |
| D. | 若含X的混合物为Fe、Al,可通过方案Ⅱ进行分离,加入的试剂是过量的NaOH溶液,1molX与足量氯气完全反应时,转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合后在光照的条件下发生反应 | |
| B. | 甲苯与Br2发生反应 | |
| C. | 乙炔与氢气的加成反应 | |
| D. | 乙烯与氯化氢的加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧产物是水,是理想的清洁燃料,未来可以利用蓝绿藻和微生物制备氢气 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为硫酸铜 | |
| C. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| D. | 硅晶体的导电性介于导体与绝缘体之间,是一种重要的半导体材料,广泛应用于制造集成电路、太阳能电池板等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
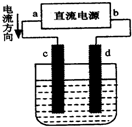
| A. | d为负极、c为正极 | B. | c电极上发生还原反应有气体产生 | ||
| C. | 电解过程中,氯离子向d电极移动 | D. | 电解过程中,d电极质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 同主族元素性质的相似性 | 钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | HF沸点低于HCl |
| D | 较强酸可以制取较弱酸 | 亚硫酸和次氯酸钙反应可以制取次氯酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p2 | C. | 3s2和3s23p5 | D. | 2s22p3和2s22p4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com