


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
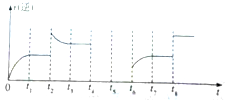
| A、升高温度该反应的正反应速率增大,逆反应速率减小 | ||
B、该反应的化学平衡常数表达式为K=
| ||
| C、绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 | ||
| D、该反应的正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
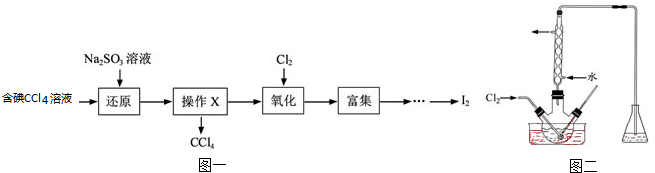
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
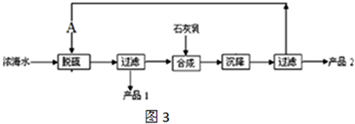
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实 验 组 | 温 度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O(g) | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
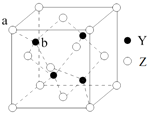 元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
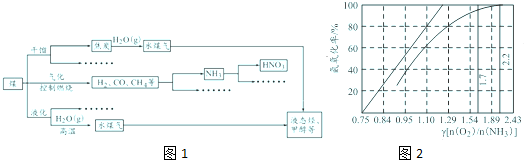
| 在微生物作用下 |
| O2/H2O |
| 在微生物作用下 |
| O2/H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H7N9型禽流感是一种新型禽流感,流感病毒通常检测方法是基于核酸检测的原理.核酸一种是蛋白质 |
| B、侯德榜发明了侯氏制碱法、维勒用氮气和氢气合成了氨气、阿伦尼乌斯创立了电离学说、扫描隧道显微镜的发明和STM技术应用等等,这些都对化学学科的应用和发展作出了重要的贡献 |
| C、使用可再生资源、注重原子的经济性、推广利用二氧化碳与环氧丙烷生成的生物降解材料等都是绿色化学的内容 |
| D、化学帮助人类创造和合成了大量材料,如高纯硅制作太阳能电池、聚氯乙烯塑料用来食品包装、人造刚玉Al2O3用作耐高温材料等等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1MPa | 2MPa | 3MPa | |
| 500℃ | 45.3% | ||
| 700℃ | a | 66.7% | |
| 900℃ | 73.6% |
| A、该反应的△H<0 |
| B、45.3%<a<66.7% |
| C、该反应的平衡常数K(900℃)<K(700℃) |
| D、700℃、2 MPa时R的转化率为50% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com