
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
分析 (1)A.甲醛中氧元素电负性很大,与水分子中H原子可以形成氢键;
B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对;
C.C6H6分子中含有12个σ键和1个大π键;
D.二氧化碳晶体属于分子晶体,二氧化硅属于原子晶体.
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其价电子排布式;原子轨道处于半满、全满、全空时能量更低稳定;
(3)元素周期表根据元素原子的外围电子排布的特征分成五个区域:s区、p区、d区、ds区、f区,s区为第ⅠA、ⅡA族,p区为第ⅢA到零族,d区包括从第ⅢB族~ⅦB族、第Ⅷ八族,ds区为第ⅠB、ⅡB族,f区为镧系和锕系;
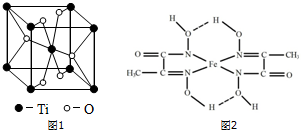
根据均摊法计算晶胞中Ti、O原子数目,进而确定化学式;
(4)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大;
②形成8电子稳定结构时,N原子形成3个共价键,微粒中N原子形成4个键,其中1个是N原子与亚铁离子形成的配位键;
(5)NiO(氧化镍)晶体的结构与NaCl相同,离子配位数为6;
以晶胞体心的Ni2+研究,与之最邻近的6个O2-位于面心,这几个O2-构成的空间构型为正八面体;
已知Ni2+与O2-的核间距为a nm,则晶胞棱长为2a nm,晶胞中Ni2+、O2-离子数目均为4,表示出晶胞的质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)A.甲醛中氧元素电负性很大,与水分子中H原子可以形成氢键,故A正确;
B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对,HCHO分子中C原子采用sp2杂化,二氧化碳分子中C原子为sp杂化,故B错误;
C.C6H6分子中含有12个σ键和1个大π键,故C错误;
D.二氧化碳晶体是分子晶体,二氧化硅晶体是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故D正确,
故答案为:AD;
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d54s2,其价电子排布式为3d54s2,
Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(3)Ti处于第四周期第ⅣB族,属于d区元素,每个晶胞中含有钛原子数为8×$\frac{1}{8}$+1=2,氧原子数为4×$\frac{1}{2}$+2=4,故化学式为TiO2,
故答案为:d;TiO2;
(4)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大,故电负性大小为O>N>C>H,
故答案为:O>N>C>H;
②形成8电子稳定结构时,N原子形成3个共价键,微粒中N原子形成4个键,其中1个是N原子与亚铁离子形成的配位键,标出配位键为: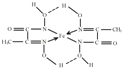 ,
,
故答案为: ;
;
(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为6,以晶胞体心的Ni2+研究,与之最邻近的6个O2-位于面心,这几个O2-构成的空间构型为正八面体;
Ni2+与O2-的核间距为a nm,则晶胞棱长为2a nm,晶胞中Ni2+、O2-离子数目均为4,晶胞的质量为6×$\frac{Mg/mol}{{N}_{A}mo{l}^{-1}}$,则晶体密度为4×$\frac{Mg/mol}{{N}_{A}mo{l}^{-1}}$÷(2a×10-7cm)3=$\frac{M×1{0}^{21}}{2{a}^{3}{N}_{A}}$g/cm3,
故答案为:6;正八面体;$\frac{M×1{0}^{21}}{2{a}^{3}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及氢键、杂化方式、化学键、电负性、核外电子排布、晶胞计算等,是对物质结构主干知识的综合考查,需要学生具备扎实的基础,注意识记中学常见晶胞结构,难度中等.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:解答题
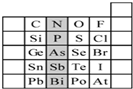 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑥ | B. | ②④⑥ | C. | 仅有⑥ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:
A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| E | 原子L电子层上有两个未成对电子 |
| F | 原子最外层有2个电子,次外层电子数为D原子最外层电子数的2倍 |
 ,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.
,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
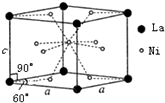 Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.
Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③⑤ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 名称或俗名 | 主要用途 |
| K2FeO4 | 高铁酸钾 | 高能材料、水处理剂和氧化剂 |
| H2C2O4 | 草酸 | 重要还原剂、菠菜成分之一 |
| KAl(SO4)2•12H2O | 明矾 | 净水剂、用于制油条和糕点 |
| Cu2O | 氧化亚铜 | 用于制红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.
碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.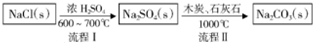
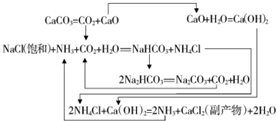
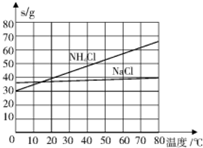
| 物质 | NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| s/g | 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com