
”¾ĢāÄæ”放ŗÓÄĻŹ”2017½ģÕļ¶Ļ¾ķ£ØA£©”æĶ¼°Ęä»ÆŗĻĪļŹĒŅ»ĄąÖŲŅŖµÄĪļÖŹ”£»Ų“šĻĀĮŠÓŠ¹ŲĪŹĢā£ŗ
£Øl£©Ä³ŹŌ¹Üµ×²æø½×ÅŅ»²ćÖĀĆܵÄĶ£¬ĻņĘäÖŠµĪ¼Ó10 mL Ļ”ĮņĖįŹ±£¬ĪŽĆ÷ĻŌĻÖĻó£¬ŌŁ¼ÓČė0.1g KNO3, Õńµ“£¬æɹŪ²ģµ½ÓŠĘųÅŻÉś³É£¬³ż“ĖĶā»¹æɹŪ²ģµ½µÄĻÖĻóŹĒ__________£¬Éś³ÉµÄĘųĢåŹĒ___£ØĢī»ÆѧŹ½£©”£
£Ø2£©ĶÓėÅØĮņĖį¼ÓČČ·“Ó¦£¬ŹµŃé½įŹųŗó¹Ū²ģµ½ŹŌ¹Üµ×²æÓŠŗŚÉ«ĪļÖŹŠĪ³É£¬ČÜŅŗ³ŹĄ¶É«£¬Ķعż¼ģŃéÖŖøĆŗŚÉ«ĪļÖŹĪŖCu2S”£Š“³öÅØĮņĖįÓėCu·“Ӧɜ³ÉCu2SµÄ»Æѧ·½³ĢŹ½£ŗ___________”£
£Ø3£©¹¤ŅµÉĻĄūÓĆŗĻ³ÉĘų£ØÖ÷ŅŖ³É·ÖĪŖCO”¢CO2ŗĶH2£©”¢æÕĘų£¬ŌŚĶ»ł“߻ƼĮ×÷ÓĆĻĀ£¬æÉŗĻ³É¼×“¼”£ŅŃÖŖ£ŗ25”ę£¬101kPaĻĀ£ŗ
H2(g)+1/2O2(g)=H2O(g) ”÷H£½-242kJ/mol£»
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ”÷H£½-676kJ/mol”£
Š“³öCO2ŗĶH2Éś³É¼×“¼µČĘųĢ¬²śĪļµÄČČ»Æѧ·½³ĢŹ½£ŗ________________”£
£Ø4£©ŗĻ³É°±¹¤ŅÕµÄŅ»øöÖŲŅŖ¹¤ŠņŹĒĶĻ“£¬ĘäÄæµÄŹĒÓĆĶŅŗ[“×Ėį¶ž°±ŗĻĶ£ØI£©”¢°±Ė®]ĪüŹÕŌŚÉś²ś¹ż³ĢÖŠ²śÉśµÄĢ¼µÄŃõ»ÆĪļ”£ĶŅŗĪüŹÕCOµÄ»Æѧ·½³ĢŹ½ĪŖ
Cu(NH3)2Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3CO]Ac(aq£© ”÷H
[Cu(NH3)3CO]Ac(aq£© ”÷H
¢Ł Čē¹ūŅŖĢįøßÉĻŹö·“Ó¦µÄ·“Ó¦ĖŁĀŹ£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ŹĒ______£ØĢī×ÖÄø£©”£
a£®ŌöŃ¹ b£®Ōö¼ÓNH3µÄÅØ¶Č c£®Ōö“óCu(NH3)2AcÅضČ
d£®½µĪĀ e£®¼õŠ”[Cu(NH3)3CO]AcÅضČ
¢Ś ŗĻ³É°±·“Ó¦ÖŠ£¬ŌŚ²»Ōö¼õ·“Ó¦Īļ»ņÉś³ÉĪļµÄĒéæöĻĀ£¬²»¶Ļøı䷓ӦĢõ¼ž£¬·“Ó¦ĖŁĀŹÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ

t4”«t5øıäµÄĢõ¼žæÉÄÜŹĒ__________£¬H2×Ŗ»ÆĀŹ×īøߵď±¼ä¶ĪŹĒ________”£ČōijĪĀ¶ČĻĀ£¬3xmolH2ŗĶxmolN2·“Ó¦£¬ŌŚ1LµÄĆܱÕČŻĘ÷ÖŠ, H2µÄ×īøß×Ŗ»ÆĀŹĪŖ50%£¬ŌņøĆĪĀ¶ČĻĀ2NH3(g)![]() 3H2(g)+N2(g)µÄĘ½ŗā³£ŹżK=_____£Ø±£ĮōĮ½Ī»Š”Źż£©”£
3H2(g)+N2(g)µÄĘ½ŗā³£ŹżK=_____£Ø±£ĮōĮ½Ī»Š”Źż£©”£
”¾“š°ø”æĶÖš½„Čܽā£¬ČÜŅŗ±äĪŖĄ¶É« NO 5Cu+4H2SO4![]() Cu2S+3CuSO4+4H2O
Cu2S+3CuSO4+4H2O
CO2(g)+3H2(g)=CH3OH(g)+H2O(g£©”÷H£½-50kJ/mol abc ¼õŠ”Ń¹Ēæ t0”«tl 1.69x2
”¾½āĪö”æ£Ø1£©ĖįŠŌČÜŅŗÖŠĻõĖįøł¾ßÓŠĒæŃõ»ÆŠŌ£¬ÄÜŗĶ½šŹōĶ·“Ó¦£¬æɹŪ²ģµ½ÓŠĘųÅŻÉś³É£¬³ż“ĖĶā»¹æɹŪ²ģµ½µÄĻÖĻóŹĒĶÖš½„Čܽā£¬ČÜŅŗ±äĪŖĄ¶É«£¬Éś³ÉµÄĘųĢåŹĒNO£»£Ø2£©øł¾Żµē×ӵƏ§ŹŲŗćŗĶŌ×ÓŹŲŗćæÉÖŖÅØĮņĖįÓėCu·“Ӧɜ³ÉCu2SµÄ»Æѧ·½³ĢŹ½ĪŖ5Cu+4H2SO4![]() Cu2S+3CuSO4+4H2O”££Ø3£©ŅŃÖŖ£ŗ¢ŁH2(g)+1/2O2(g)£½H2O(g) ”÷H£½-242kJ/mol£¬¢ŚCH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ”÷H£½-676kJ/mol£¬øł¾ŻøĒĖ¹¶ØĀÉ¢Ł”Į3£¢Ś¼“æɵƵ½CO2ŗĶH2Éś³É¼×“¼µČĘųĢ¬²śĪļµÄČČ»Æѧ·½³ĢŹ½ĪŖCO2(g)+3H2(g)=CH3OH(g)+H2O(g£©”÷H=-50kJ/mol”££Ø4£©¢Ła£®ŌöŃ¹·“Ó¦ĖŁĀŹ¼Óæģ£¬aÕżČ·£»b£®Ōö¼ÓNH3µÄÅØ¶Č·“Ó¦ĖŁĀŹ¼Óæģ£¬bÕżČ·£»c£®Ōö“óCu(NH3)2AcÅØ¶Č·“Ó¦ĖŁĀŹ¼Óæģ£¬cÕżČ·£»d£®½µĪĀ·“Ó¦ĖŁĀŹ¼õŠ”£¬d“ķĪó£»e£®¼õŠ”[Cu(NH3)3CO]AcÅØ¶Č·“Ó¦ĖŁĀŹ¼õŠ”£¬e“ķĪ󣬓š°øŃ”abc£»¢ŚŗĻ³É°±·“Ó¦ŹĒĢå»ż¼õŠ”µÄ·ÅČČ·“Ó¦£¬t4”«t5ÕżÄę·“Ó¦ĖŁĀŹ¾ł¼õŠ”£¬Ę½ŗāĻņÄę·“Ó¦·½Ļņ¼õŠ”£¬øıäµÄĢõ¼žæÉÄÜŹĒ¼õŠ”Ń¹Ēæ£¬Ę½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬ÓŠĄūÓŚĢįøßĒāĘų×Ŗ»ÆĀŹ£¬Ōņøł¾ŻĶ¼ĻńæÉÖŖH2×Ŗ»ÆĀŹ×īøߵď±¼ä¶ĪŹĒ t0”«tl”£ČōijĪĀ¶ČĻĀ£¬3xmolH2ŗĶxmolN2·“Ó¦£¬ŌŚ1LµÄĆܱÕČŻĘ÷ÖŠ, H2µÄ×īøß×Ŗ»ÆĀŹĪŖ50%£¬ŌņĻūŗÄĒāĘųŹĒ1.5xmol”¢µŖĘųŹĒ0.5xmol£¬Éś³É°±ĘųŹĒ1.0xmol£¬ĖłŅŌøĆĪĀ¶ČĻĀ2NH3(g)
Cu2S+3CuSO4+4H2O”££Ø3£©ŅŃÖŖ£ŗ¢ŁH2(g)+1/2O2(g)£½H2O(g) ”÷H£½-242kJ/mol£¬¢ŚCH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ”÷H£½-676kJ/mol£¬øł¾ŻøĒĖ¹¶ØĀÉ¢Ł”Į3£¢Ś¼“æɵƵ½CO2ŗĶH2Éś³É¼×“¼µČĘųĢ¬²śĪļµÄČČ»Æѧ·½³ĢŹ½ĪŖCO2(g)+3H2(g)=CH3OH(g)+H2O(g£©”÷H=-50kJ/mol”££Ø4£©¢Ła£®ŌöŃ¹·“Ó¦ĖŁĀŹ¼Óæģ£¬aÕżČ·£»b£®Ōö¼ÓNH3µÄÅØ¶Č·“Ó¦ĖŁĀŹ¼Óæģ£¬bÕżČ·£»c£®Ōö“óCu(NH3)2AcÅØ¶Č·“Ó¦ĖŁĀŹ¼Óæģ£¬cÕżČ·£»d£®½µĪĀ·“Ó¦ĖŁĀŹ¼õŠ”£¬d“ķĪó£»e£®¼õŠ”[Cu(NH3)3CO]AcÅØ¶Č·“Ó¦ĖŁĀŹ¼õŠ”£¬e“ķĪ󣬓š°øŃ”abc£»¢ŚŗĻ³É°±·“Ó¦ŹĒĢå»ż¼õŠ”µÄ·ÅČČ·“Ó¦£¬t4”«t5ÕżÄę·“Ó¦ĖŁĀŹ¾ł¼õŠ”£¬Ę½ŗāĻņÄę·“Ó¦·½Ļņ¼õŠ”£¬øıäµÄĢõ¼žæÉÄÜŹĒ¼õŠ”Ń¹Ēæ£¬Ę½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬ÓŠĄūÓŚĢįøßĒāĘų×Ŗ»ÆĀŹ£¬Ōņøł¾ŻĶ¼ĻńæÉÖŖH2×Ŗ»ÆĀŹ×īøߵď±¼ä¶ĪŹĒ t0”«tl”£ČōijĪĀ¶ČĻĀ£¬3xmolH2ŗĶxmolN2·“Ó¦£¬ŌŚ1LµÄĆܱÕČŻĘ÷ÖŠ, H2µÄ×īøß×Ŗ»ÆĀŹĪŖ50%£¬ŌņĻūŗÄĒāĘųŹĒ1.5xmol”¢µŖĘųŹĒ0.5xmol£¬Éś³É°±ĘųŹĒ1.0xmol£¬ĖłŅŌøĆĪĀ¶ČĻĀ2NH3(g)![]() 3H2(g)+N2(g)µÄĘ½ŗā³£ŹżK£½
3H2(g)+N2(g)µÄĘ½ŗā³£ŹżK£½![]() ”£
ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗ¬ÓŠMgCl2”¢NaCl”¢Na2SO4ČżÖÖĪļÖŹµÄ»ģŗĻČÜŅŗ£¬ĘäÖŠŗ¬ÓŠCl£ĪŖ1.8mol£¬Na+ĪŖ2mol£¬Mg2+ĪŖ0.5mol£¬ŌņSO42£µÄĪļÖŹµÄĮæĪŖ£Ø””””£©
A. 0.6mol B. 0.7mol C. 1.2mol D. 1.0mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃéÖŠ£¬·“Ó¦ĖŁĀŹ¼ÓæģŹĒÓɓ߻ƼĮŅżĘšµÄ£Ø £©
A£®ŌŚĢæ·ŪÖŠ¼ÓČėKClO3£¬µćČ¼Ź±Č¼ÉÕøüĪŖ¾ēĮŅ
B£®ŠæÓėĻ”ĮņĖį·“Ó¦ÖŠ¼ÓČėÉŁĮæCuSO4ČÜŅŗ¶ųŹ¹·“Ó¦·Å³öH2µÄĖŁĀŹ¼Óæģ
C£®¹ĢĢ¬FeCl3ŗĶ¹ĢĢåNaOH»ģŗĻŗ󣬼ÓČėĖ®ÄÜŃøĖŁ²śÉś³Įµķ
D£®Ė«ŃõĖ®ÖŠ¼ÓČėÉŁĮæMnO2£¬¼“æÉŃøĖŁ·Å³öĘųĢå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ęĢõ¼žĻĀ£¬Ļņ10 mL 0.1 mol”¤L”„1µÄHRČÜŅŗÖŠÖšµĪµĪČė0.1 mol”¤L”„1µÄNH3”¤H2OČÜŅŗ£¬ĖłµĆČÜŅŗpH¼°µ¼µēŠŌ±ä»ÆČēĶ¼”£ĻĀĮŠ·ÖĪö²»ÕżČ·µÄŹĒ£Ø £©
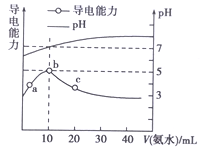
A. a~bµćµ¼µēÄÜĮ¦ŌöĒ棬ĖµĆ÷HRĪŖČõĖį
B. bµćČÜŅŗpH=7ĖµĆ÷NH4Rƻӊ·¢ÉśĖ®½ā
C. cµćČÜŅŗ“ęŌŚc(NH4+)>c(R”„)”¢c(OH”„)>c(H+)
D. b~cČĪŅāµćČÜŅŗ¾łÓŠc(H+)”¤c(OH”„)=KW=1.0”Į10”„14
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓÉ1-ä嶔ĶéŗĶ±ŲŅŖµÄĪŽ»śŹŌ¼ĮÖĘČ”1-¶”Č²£¬Ęä¹ż³ĢÖŠĻČŗó·¢ÉśµÄ·“Ó¦ĄąŠĶŹĒ
¢ŁČ”“ś ¢Ś¼Ó³É ¢ŪĻūČ„ ¢Ü¼Ó¾Ū
A. ¢Ł¢Ū¢Ü B. ¢Ū¢Ś¢Ł C. ¢Ū¢Ś¢Ū D. ¢Ł¢Ś¢Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼ģŃéSO2ÖŠŹĒ·ńŗ¬ÓŠCO2Ó¦²ÉÓƵķ½·ØÓŠ
A. ĶعżŹÆ»ŅĖ® B. ĶعżĘ·ŗģČÜŅŗ
C. ĻČĶعżŠ”ĖÕ“ņČÜŅŗ£¬ŌŁĶعżŹÆ»ŅĖ® D. ĻČĶعż×ćĮæäåĖ®ČÜŅŗ£¬ŌŁĶعżŹÆ»ŅĖ®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°Ń200 mL K2CO3ŗĶNH4HCO3µÄ»ģŗĻČÜŅŗ·Ö³ÉĖĵȷŻ£¬Č”Ņ»·Ż¼ÓČėŗ¬0.35 mol HClµÄŃĪĖįĒ”ŗĆ·“Ó¦ĶźČ«£¬ĮķČ”Ņ»·Ż¼ÓČėŗ¬0.3 molĒāŃõ»Æ¼ŲµÄČÜŅŗĒ”ŗĆ·“Ó¦ĶźČ«£¬ŌņøĆ»ģŗĻČÜŅŗÖŠc£ØK+£©ĪŖ£Ø””””£©
A. 1 mol”¤L-1 B. 2 mol”¤L-1 C. 3mol”¤L-1 D. 4 mol”¤L-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠĻĀĮŠŹ®ÖÖĪļÖŹ£ŗ
¢ŁHCl ¢ŚNaHCO3 ¢ŪNaClČÜŅŗ ¢ÜCO2 ¢ŻÕįĢĒ¹ĢĢå
¢ŽCa£ØOH£©2 ¢ßĒāŃõ»ÆĢś½ŗĢå ¢ąNH3”¤H2O ¢įæÕĘų ¢āAl2£ØSO4£©3
£Ø1£©ÉĻŹöĪļÖŹÖŠŹōÓŚµē½āÖŹµÄÓŠ_________£¬·Ēµē½āÖŹµÄÓŠ____________”££ØĢīŠņŗÅ£©
£Ø2£©Ļņ¢ßÖŠÖšµĪµĪ¼Ó¢ŁµÄĖ®ČÜŅŗ£¬æ“µ½µÄĻÖĻó___________________________________”£
£Ø3£©¢ŚŌŚĖ®ČÜŅŗÖŠµÄµēĄė·½³ĢŹ½ĪŖ___________________________________”£
£Ø4£©Ļņ¢āÖŠµĪ¼ÓÉŁĮæ¢ąµÄĖ®ČÜŅŗ£¬·“Ó¦Ąė×Ó·½³ĢŹ½________________________________”£
£Ø5£©ĪøŅŗÖŠŗ¬ÓŠŃĪĖį£¬ĪøĖį¹ż¶ąµÄČĖ³£ÓŠĪøĢŪÉՊĵÄøŠ¾õ£¬·žÓĆŹŹĮæµÄŗ¬Al£ØOH£©3µÄĪøŅ©£ØČēĪøŹęĘ½£©£¬ÄÜÖĪĮĘĪøĖį¹ż¶ą£¬ĒėŠ“³öĘä·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_________________________”£
£Ø6£©Ņ©Īļ”°“ļĻ²”±µÄ»Æѧ³É·ÖŹĒĀĮŗĶĆ¾µÄ¼īŹ½ŃĪ£¬Ņ²æÉÓĆÓŚÖĪĮĘĪøĖį¹ż¶ą”£Č”Ņ»¶ØĮæøĆ¼īŹ½ŃĪ£¬¼ÓČė2.0 mol/LŃĪĖįŹ¹ĘäČܽā£¬µ±¼ÓČėŃĪĖį42.5 mLŹ±æŖŹ¼²śÉśCO2£¬¼ÓČėŃĪĖįÖĮ45.0 mLŹ±Ē”ŗĆ·“Ó¦ĶźČ«£¬øĆ¼īŹ½ŃĪѳʷ֊ĒāŃõøłÓėĢ¼ĖįøłµÄĪļÖŹµÄĮæÖ®±ČĪŖ_____”£ £ØŅŃÖŖ£ŗ ![]() £©
£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓ¦¶ŌĪķö²ĪŪČ¾”¢øÄÉĘæÕĘųÖŹĮæŠčŅŖ“Ó¶ą·½ĆęČėŹÖ”£
I.ŃŠ¾æ·¢ĻÖ£¬NOxŹĒĪķö²µÄÖ÷ŅŖ³É·ÖÖ®Ņ»£¬NOxÖ÷ŅŖĄ“Ō“ÓŚĘū³µĪ²Ęų”£
ŅŃÖŖ£ŗN2(g)+O2(g)![]() 2NO(g) ”÷H=+180.50kJ”¤mol£1
2NO(g) ”÷H=+180.50kJ”¤mol£1
2CO(g)+O2(g)![]() 2CO2(g) ”÷H=£566.00 kJ”¤mol£1
2CO2(g) ”÷H=£566.00 kJ”¤mol£1
ĪŖĮĖ¼õĒį“óĘųĪŪČ¾£¬ČĖĆĒĢį³öŌŚĘū³µĪ²ĘųÅÅĘų¹ÜæŚ²ÉÓĆ“ß»Æ¼Į½«NOŗĶCO×Ŗ»Æ³ÉĪŽĪŪČ¾ĘųĢå²ĪÓė“óĘųŃ»·£¬Š“³öøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ _____________”£
II.æŖ·¢ĄūÓĆĒå½ąÄÜŌ“æɼõÉŁĪŪČ¾£¬½ā¾öĪķö²ĪŹĢā”£¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśµÄĒå½ąÄÜŌ“£¬¾ßÓŠ¹ćĄ«µÄæŖ·¢ŗĶÓ¦ÓĆĒ°¾°£¬Ņ»¶ØĢõ¼žĻĀÓĆCOŗĶH2ŗĻ³ÉCH3OH£ŗCO(g)+2H2(g)![]() CH3OH(g)£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠ³äČėĪļÖŹµÄĮæÖ®±ČĪŖ1:2µÄCOŗĶH2£¬ŌŚ“߻ƼĮ×÷ÓĆĻĀ³ä·Ö·“Ó¦”£Ę½ŗā»ģŗĻĪļÖŠCH3OHµÄĢå»ż·ÖŹżŌŚ²»Ķ¬Ń¹ĒæĻĀĖęĪĀ¶ČµÄ±ä»ÆČēĻĀĶ¼ĖłŹ¾”£
CH3OH(g)£¬ŌŚ2LĆܱÕČŻĘ÷ÖŠ³äČėĪļÖŹµÄĮæÖ®±ČĪŖ1:2µÄCOŗĶH2£¬ŌŚ“߻ƼĮ×÷ÓĆĻĀ³ä·Ö·“Ó¦”£Ę½ŗā»ģŗĻĪļÖŠCH3OHµÄĢå»ż·ÖŹżŌŚ²»Ķ¬Ń¹ĒæĻĀĖęĪĀ¶ČµÄ±ä»ÆČēĻĀĶ¼ĖłŹ¾”£

(1)øĆ·“Ó¦µÄ·“Ó¦ČČ”÷H _______ 0£ØĢī”°£¾”±»ņ”°£¼”±£©£¬Ń¹ĒæµÄĻą¶Ō“óŠ”ÓėP1______P2£ØĢī”°£¾”±»ņ”°£¼”±£©”£
(2)øĆ·“Ó¦»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½ĪŖ___________”£
(3)ĻĀĮŠø÷ĻīÖŠ£¬²»ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāµÄŹĒ______________”£
A.ČŻĘ÷ÄŚĘųĢåŃ¹Ēæ²»ŌŁ±ä»Æ B.v(CO):v(H2):v(CH3OH)=1:2:1
C.ČŻĘ÷ÄŚµÄĆÜ¶Č²»ŌŁ±ä»Æ D.ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»Æ
E.ČŻĘ÷ÄŚø÷×é·ÖµÄÖŹĮæ·ÖŹż²»ŌŁ±ä»Æ
(4)ijĪĀ¶ČĻĀ£¬ŌŚ±£Ö¤H2ÅØ¶Č²»±äµÄĒéæöĻĀ£¬Ōö“óČŻĘ÷µÄĢå»ż£¬Ę½ŗā______(Ģī×ÖÄø)”£
A.ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ B.ĻņÄę·“Ó¦·½ĻņŅĘ¶Æ C.²»ŅʶÆ
III.ŅĄ¾ŻČ¼ÉÕ·“Ó¦ŌĄķ£¬ŗĻ³ÉµÄ¼×“¼æÉŅŌÉč¼ĘČēĶ¼ĖłŹ¾µÄČ¼ĮĻµē³Ų×°ÖĆ”£

(5)øŗ¼«µē¼«·“Ó¦Ź½ĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com