
���� ��1���������Ʋ����Ǽ��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��������Ҫ��������
��2������n=cV��m=nM�����㣻
��3���������Ʋ����Ǽ��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ���Բ���˳���������
��4������c=$\frac{n}{V}$��������ʵ����ʵ���n����Һ�����V�ı仯��������������
��� �⣺��1������ʵ������240mL������ƿ����Ӧѡ��250mL������ƿ���������Ʋ����Ǽ��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��֪����������У�������ƽ���ձ�����������250mL����ƿ�ͽ�ͷ�ιܣ����ò���������ΪCF���ʴ�Ϊ��CF��
��2������ʵ������240mL������ƿ����Ӧѡ��250mL������ƿ�����Ƴ�250mL��Һ����������������Ƶ�����m=CVM=2mol/L��0.25L��40g/mol=20.0g��
�ʴ�Ϊ��20.0��
��3���������Ʋ����Ǽ��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��֪��ȷ�IJ���˳��Ϊ��CBEAGHDF���ʴ�Ϊ��CBEAGHDF��
��4��������2mol/L��NaOH��Һ����ϴ����ƿ��������ƿ�����ʵ����ʵ���ƫ�࣬��ת����Һ����������Һ��Ũ�Ƚ�ƫ�ʴ�Ϊ��ƫ��
��������ʱ���ӿ̶��ߣ�����Һ�����ƫС����ʵ������ƫ�ʴ�Ϊ��ƫ��
������Һδ��ȴ��ת�Ƶ�����ƿ�����̼�ˮ���̶��ߣ�����ȴ����Һ���ƫС����ʵ������ƫ�ʴ�Ϊ��ƫ��
���� ���⿼����һ�����ʵ���Ũ����Һ�����ƹ����еļ���������������ڻ�������Ŀ���ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� | CH3-C��C-CH3 | C�� | 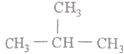 | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3-������ | B�� | 2-��-3-�һ����� | ||
| C�� | 2��2-�������� | D�� | 2��3-�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ���� | C�� | ��֬ | D�� | ά���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ũ�ȴﵽ1 mol•L-1 | |
| B�� | H+��Ũ�ȴﵽ0.5 mol•L-1 | |
| C�� | ������ӵ�Ũ�ȡ���������ӵ�Ũ�ȡ�H+��Ũ�Ⱦ�Ϊ0.5 mol•L-1 | |
| D�� | ������ӵ�������ӵ����ʺ��������½�ϳɴ�����ӵ�������ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | ��ʼ�� ����pH | ��ȫ�� ����pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.7 | 3.2 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H5OH��l��+3O2��g���T2CO2��g��+3H2O��g����H=-1367.0 kJ/mol��ȼ���ȣ� | |
| B�� | S��s��+O2��g���TSO2��g����H=-269.8kJ/mol����Ӧ�ȣ� | |
| C�� | NaOH��aq��+HCl��aq���TNaCl��aq��+H2O��l����H=+57.3kJ/mol���к��ȣ� | |
| D�� | 2NO2�TO2+2NO��H=+116.2kJ/mol����Ӧ�ȣ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com