
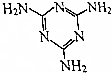
 三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )
三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )| A. | 三聚氰胺的分子式为C3H6N6 | |
| B. | 氰胺的结构简式为H2N-C≡N | |
| C. | 尿素分解制三聚氰胺时,除生成CO2外,还会生成NH3 | |
| D. | 三聚氰胺属于高分子化合物 |
分析 A.根据结构简式确定分子式;
B.氰胺含有氨基和C≡N键;
C.根据质量守恒判断;
D.根据高分子化合物的定义判断.
解答 解:A.由三聚氰酸的结构简式可知,其分子式为C3H3N3O3,故A正确;
B.氰胺含有氨基和C≡N键,结构简式为H2N-C≡N,故B正确;
C.尿素[CO(NH2)2]在一定条件下反应生成三聚氰胺,同时放出氨气和二氧化碳气体的反应方程式:6CO(NH2)2=C3H6N6+6NH3↑+3CO2↑,故C正确;
D.高分子化合物的相对分子质量在10000以上,三聚氰胺不属于高分子化合物,故D错误.
故选D.
点评 本题考查有机物结构与性质,为高频考点,侧重对基础知识的巩固,涉及化学键、高分子化合物等考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 酸性溶液中:NH4+、Na+、ClO-、SO42- | |
| C. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| D. | 滴入KSCN溶液显红色的溶液中:Na+、K+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ○ |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷(丙烯),酸性高锰酸钾溶液 | B. | 甲烷(乙炔),溴的四氯化碳溶液 | ||
| C. | 溴苯(溴),苯 | D. | 硝基苯(硝酸),苯和浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa与O2完全反应生成Na2O2和Na2O的混合物,转移电子的总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17g甲基(-14CH3)含有的电子数为9NA | |
| D. | 常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3+2△H1+2△H2 | B. | △H3+2△H1+△H2 | C. | △H3+2△H1-△H2 | D. | △H3+2△H1-2△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② | “测定残留固体镁的质量”或“测定反应消耗或剩余的NaOH的量”或“测定生成的NaAlO2的量” |
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com