
 计算判断;
计算判断;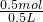 =1mol/L,故A正确;
=1mol/L,故A正确;

科目:高中化学 来源: 题型:
 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸盐化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加溶液,加热,加入的氢氧化钠溶液体积(V)与生成的沉淀、产生的气体关系(n)如右图. |  |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO2)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(SO2)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分,每空2分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下平衡常数K1=________。
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知 该反应的正反应为___________反应(填“吸热”、“放热”)。
(3)在(1)的基础上,压缩容器体积之0.5L。该条件下的平衡常数为K3。则K3________K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s) 2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
(1)0~10min 容器内气体的压强逐渐 ___________。
(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___
第13min时曲线变化的原因可能是 __(填序号)
①增加Z的量 ②增加X的量 ③升温
④降温 ⑤使用催化剂
查看答案和解析>>
科目:高中化学 来源:2011-2012年学福建省永安一中高二上学期期中考试化学试卷 题型:填空题
(14分,每空2分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下平衡常数K1=________。
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知 该反应的正反应为___________反应(填“吸热”、“放热”)。
(3)在(1)的基础上,压缩容器体积之0.5 L。该条件下的平衡常数为K3。则K3________K1
L。该条件下的平衡常数为K3。则K3________K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2 )=1.2mol,n(H2)=1.5mol,
)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密 闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)
闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。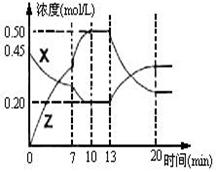
(1)0~10min 容器内气体的压强逐渐 ___________。
(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___
第13min时曲线变化的原因可能是  __(填序号)
__(填序号)
①增加Z的量 ②增加X的量 ③升温
④降温 ⑤使用催化剂
查看答案和解析>>
科目:高中化学 来源:2011-2012年学福建省高二上学期期中考试化学试卷 题型:填空题
(14分,每空2分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下平衡常数K1=________。
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知 该反应的正反应为___________反应(填“吸热”、“放热”)。
(3)在(1)的基础上,压缩容器体积之0.5L。该条件下的平衡常数为K3。则K3________K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
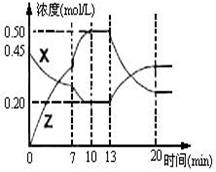
(1)0~10min 容器内气体的压强逐渐 ___________。
(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___
第13min时曲线变化的原因可能是 __(填序号)
①增加Z的量 ②增加X的量 ③升温
④降温 ⑤使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com