
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.标准状况下,22.4L H2O含有NA个分子
B.1L 1mol·L -1的NaClO 溶液中含有ClO-的数目少于NA个
C.0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子
D.0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:选择题
氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是
A.AgCN难溶于水
B.MnO2不能与HCN反应生成(CN)2
C.HCN易形成白雾
D.(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1

下列说法正确的是
A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>—192.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期考试化学试卷(解析版) 题型:填空题
(9分)
氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
(1)下面是利用氮气的一种途径

①步骤I中主要利用N2与液态空气中其它成分的________(填性质)不同。
②最新研究发现在碱性溶液中通过电解反应2N2+6H2O 4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
4NH3+3O2实现氮的固定,阴极上发生的电极反应式为___________________________________。
(2)氨气可以用于侯氏制碱法,其流程如下图所示:
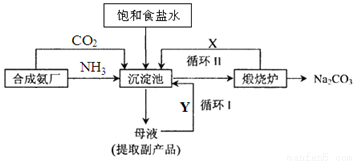
①循环I、II中循环利用的物质X是_________,Y是__________。(填化学式)
②向沉淀池中通入气体时,需要先通入NH3,再通入CO2,其原因是______________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.电解饱和NaCl溶液:2Cl-+2H+  H2↑+Cl2↑
H2↑+Cl2↑
B.向Na2SO3溶液中滴加足量NaClO溶液: + ClO-=
+ ClO-=  + Cl-
+ Cl-
C.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D.向Ca(OH)2溶液中加少量NaHCO3溶液:
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高三上学期第一次月考化学试卷(解析版) 题型:选择题
用0.2 mol/L Na2SO3溶液32 mL,还原含2×10-3 mol X2O72-的溶液,过量的Na2SO3用0.1 mol/L KMnO4酸性溶液氧化(其中KMnO4被还原成Mn2+),共消耗KMnO4溶液1.6 mL,则元素X在还原产物中的化合价是
A.+3 B.+4 C.+5 D.+6
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中化学试卷(解析版) 题型:填空题
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4?7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、蒸发皿外还需要的主要仪器为 。
(2)“碱浸”过程中发生的离子方程式是 。
(3)“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是: 。
(5)“调pH为2~3”的目的是 。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 __。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:选择题
对于反应A2(g)+ 3B2(g) 2C(g),以下表示其化学反应速率最快的是
2C(g),以下表示其化学反应速率最快的是
A.v(A2) =0.4mol/(L?s) B.v(B2) =0.8mol/(L?s)
C.v(C) =0.6mol/(L?s) D.v(B2) =4.2mol/(L?min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com