
| A. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO${\;}_{3}^{-}$) | |
| D. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
分析 A.CH3COONa和CH3COOH混合溶液使pH=7,显示中性,结合电荷守恒可知c(Na+)=c(CH3COO-);
B.根据硫酸根离子对BaSO4(s)?Ba2+(aq)+SO42-(aq)的影响进行判断;
C.1mol氢氧化钾与1mol二氧化碳恰好反应生成碳酸氢钾,由于碳酸氢根离子部分水解,则c(K+)>c(HCO3-);
D.强酸强碱不一定是一元强酸和一元强碱.
解答 解:A.CH3COONa和CH3COOH混合溶液,当混合液的pH=7时c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-),所以醋酸钠溶液中加入醋酸,可以满足条件,故A正确;
B.硫酸钡溶液中存在溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq),加入硫酸钠后溶液中硫酸根离子浓度增大,则钡离子浓度减小,故B错误;
C.1molKOH与1molCO2恰好反应生成碳酸氢钾,由于HCO3-部分水解,导致碳酸氢根离子部分水解,则c(K+)>c(HCO3-),故C错误;
D.强酸强碱不一定是一元强酸和一元强碱,等浓度等体积混合可能酸过量或碱过量,无法判断溶液酸碱性,故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握难溶物溶解平衡及其影响,能够利用电荷守恒判断溶液中离子浓度大小,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
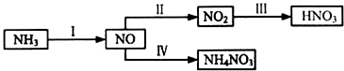
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | a | b | c |
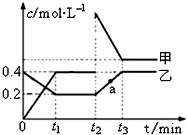
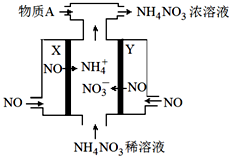
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
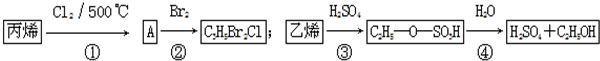
| A. | 反应①与反应④均是取代反应 | |
| B. | 反应②与反应③均是加成反应 | |
| C. | 反应②中产物的结构简式为CH2BrCH2CHClBr | |
| D. | 反应③、④表明硫酸是乙烯与水反应的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应:Fe-2e-═Fe2+ | |
| B. | 阴极反应:2H++2e-═H2↑ | |
| C. | 在电解过程中工业废水由酸性变为碱性 | |
| D. | 可以将铁电极改为石墨电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com