
【题目】已知反应:NaH+H2O=H2+NaOH,对该反应的判断正确的是( )
A.1mol NaH参加反应失去1mol电子
B.每生成1mol H2转移2mol电子
C.NaH既是氧化剂,又是还原剂
D.NaOH是氧化产物
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
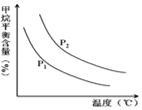
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:苯与液溴在溴化铁的催化作用下可以发黄色呢个反应生成溴苯。某同学用如图的装置制取溴苯并证明发生的是取代反应。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中,已知溴可溶于溴苯中。
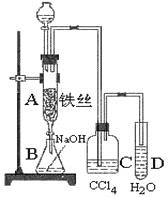
(1)写出A中反应的化学方程式______________________________________________________
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________________________,写出有关反应的化学方程式______________________________________。
(3) C中盛放CCl4的作用是______________________________。
(4)向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明该反应为取代反应。另一种证明的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学与生活的说法错误的是( )
A.铁粉、生石灰均可作食品抗氧化剂
B.明矾、氯化铁均可作净水剂
C.牛奶、鸡蛋清均可用于重金属中毒解毒
D.碘酒、双氧水均可用于伤口消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度下,子一个10L的恒容密闭容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
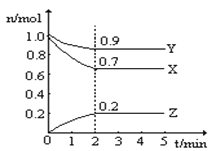
(1)该反应的化学方程式为_____________ ;
(2)反应开始至2min,以气体Z表示的平均反应速率为_____________;
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:
①混合气体的压强②混合气体的密度③混合气体的总物质的量④混合气体的颜色⑤混合气体的平均相对分子质量⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明A(s)+2B(g) ![]() C(g)+D(g)达到平衡状态的是_______。
C(g)+D(g)达到平衡状态的是_______。
Ⅲ. 将 6mol A气体 与 2mol B气体在2L密闭容器中混合并在一定条件下发生反应:
3A(g)+B(g)![]() xC(g)+2D(g).若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L·min),请填写下列空白:
xC(g)+2D(g).若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L·min),请填写下列空白:
①x的数值为______;
②5min时B的转化率为______;
③若升高温度,V逆_________(填“变大”“变小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A~I之间的转化关系如图所示:
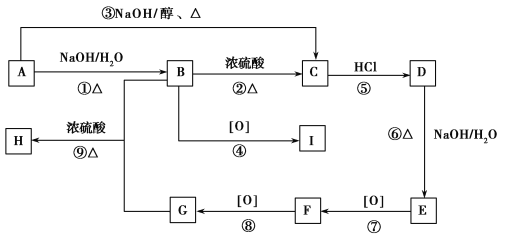
①A与D、B与E、I与F互为同分异构体;
②C的最简式与乙炔相同,且相对分子质量为104;
③A~I均为芳香族化合物。
根据以上信息,回答下列问题:
(1)G中含有的官能团名称为________________。
(2)H的结构简式________________。
(3)I与F互为同分异构体,下列能够鉴别两者的方法或试剂是________。
A.李比希法 B.质谱法 C.红外光谱法 D.核磁共振氢谱法 E.银氨溶液
(4)写出反应⑥的化学方程式:_______________________________。
(5)写出E→F反应的化学方程式:____________________________。
(6)苯环上含有两个取代基且能与NaOH溶液反应,但不与FeCl3溶液发生显色反应的G的同分异构体有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_____。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液的密度 D.溶液中Cl-的数目
(3)下列容量瓶的使用方法中,不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.200 mol·L-1的稀盐酸。
①该学生需要用量筒量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏大的有_____
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容。
B.用量筒量取浓盐酸时俯视观察凹液面。
C.在容量瓶中定容时俯视刻度线。
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学习的电化学知识,下列说法正确的是
A. 太阳能电池的主要材料为二氧化硅
B. 铁与电源正极连接可实现电化学保护
C. 酸雨后钢铁易发生析氢腐蚀、铁锅存留盐液时易发生吸氧腐蚀
D. iPhone7s用的锂离子电池属于一次电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
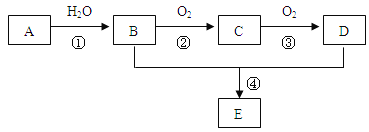
(1)写出A的结构简式 。
(2)B、D分子中所含官能团的名称分别是 、 。
(3)物质B可以直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
反应②的化学方程式: 。反应类型: ;
反应④的化学方程式: 。反应类型: ;
(5)B可由含淀粉的浓产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出淀粉水解的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com