
| A. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 断开化学键的过程会放出能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 酸碱中和反应都是吸热反应 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | |
| 容积 | 1L | 1L | 0.5L |
| 起始加入物质 | X:2mol,Y:1mol | Z:2mol | X:0.5mol,Y:0.25mol |
| 平衡时 | c(Z)=1.2mol•L-1 | c(Z)=1.2mol•L-1 |
| A. | T℃时该反应的平衡常数K为3.75 | |
| B. | 平衡时,X转化率:甲<丙 | |
| C. | 若乙是绝热容器,则平衡时,c(Z)>1.2mol•L-1 | |
| D. | 前2min内,丙容器中用X表示的平均反应速率v(X)=0.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1g H2和8 gO2 | |
| B. | 0.1mol HCl 和2.24 L He | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
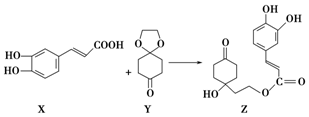
| A. | X的分子式为C9H8O4 | |
| B. | Y、Z中均含1个手性碳原子 | |
| C. | Z能发生加成反应、取代反应及消去反应 | |
| D. | 1 mol Z至多可与3 mol Br2发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com