
| A、2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 |
| B、1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| C、在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 |
| D、1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
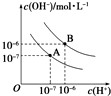 已知水在25℃(A)和T℃(B)时,其电离平衡曲线如图所示:
已知水在25℃(A)和T℃(B)时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纤维素属于多糖,在人体内水解转化为葡萄糖,也可为人类提供能量 |
| B、糖尿病患者吃糖量必须限制,但淀粉类食物不必进行限制 |
| C、同质量的脂肪在体内氧化放出的能量比糖类和蛋白质高得多,是提供能量的主要物质 |
| D、葡萄糖在人体内不可以转化为脂肪,所以吃糖不会使人发胖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | KMnO4,HCl | Cl2、MnCl2… |
| A、第①组反应中,H2O2作还原剂 |
| B、第②组反应中,Cl2与FeBr2的物质的量之比为3:2 |
| C、第③组反应中,每生成1molCl2转移电子2mol |
| D、从三个反应可以得出:氧化性由强到弱顺序为MnO4->Fe3+>Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除③外 | B、除③⑤外 |
| C、除③④外 | D、除⑥外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、20℃时,KNO3的溶解度S=
| ||
B、该溶液的质量分数W (KNO3)=
| ||
C、该溶液的物质的量浓度C (KNO3)=
| ||
D、该溶液的密度ρ=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、142g |
| B、71g |
| C、0.05mol |
| D、0.025mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤ | B、②③ |
| C、①③④ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
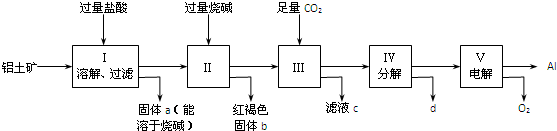
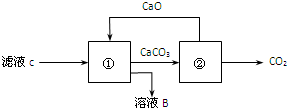
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com