
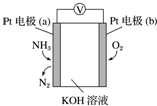
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 负极的电极反应式为2NH3-6e-+6OH-═N2+6H2O |
分析 Pt(a)通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,正极上氧气得电子被还原,结合电极方程式解答该题.
解答 解:A.a极为负极,b极为正极,氧气在正极上得电子发生还原反应,故A正确;
B.因为a极为负极,则溶液中的阴离子向负极移动,即溶液中OH-向电极a移动,故B正确;
C.反应中N元素化合价升高3价,O元素化合价降低4价,根据得失电子守恒,消耗NH3与O2的物质的量之比为4:3,故C错误;
D.负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3-6e-+6OH-=N2+6H2O,故D正确.
故选C.
点评 本题考查了原电池原理,根据O、N元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,为易错点;题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:填空题
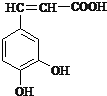 I、已知咖啡酸的结构如图所示.
I、已知咖啡酸的结构如图所示. ,A 的同分异构体中只有一种类型的氢原子的结构简式为C(CH3)2═C(CH3)2.
,A 的同分异构体中只有一种类型的氢原子的结构简式为C(CH3)2═C(CH3)2.
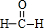 ,①的反应类型为加成反应,一定条件下,1,3-丁二烯反应生成的高分子结构简式为-[CH2-CH=CH-CH2]-n.
,①的反应类型为加成反应,一定条件下,1,3-丁二烯反应生成的高分子结构简式为-[CH2-CH=CH-CH2]-n.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| B. | 一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱 | |
| C. | 水的离子积只与温度有关,向水中加入酸、碱或盐一定会影响水的电离平衡 | |
| D. | 硅是应用广泛的半导体材料,常温下只与氟气、氢氟酸反应,不和任何其它物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”和画“×”分别标明B和N的相对位置.
”和画“×”分别标明B和N的相对位置.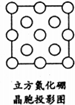
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
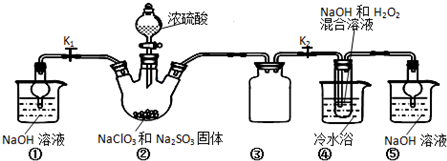
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH3+(甲基碳正离子)含有的电子数目为9NA | |
| B. | 27g Al在标准状况下的22.4L Cl2中燃烧,转移的电子总数为3 NA | |
| C. | 0.2 mol•L-1的Na2CO3溶液中含有CO32-的数目一定小于0.2NA | |
| D. | 7.8gNa2S和Na2O2的混合物中含有的阴离子总数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | NaCl、NaBr、NaI | C. | NaBr、NaI | D. | NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验操作 | 预期现象与结论 | 相关离子方程式 |
| 取少量实验Ⅰ中的澄清溶液,加入试剂适量的KSCN溶液 | 如果溶液显红色,则黑色物质为Fe3O4,反之则为FeO | Fe3++3SCN-═Fe(SCN)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com