
科目:高中化学 来源: 题型:解答题
 ,AC2的电子式
,AC2的电子式
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石灰石与稀盐酸制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应生成白色沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水反应后的溶液显碱性:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 二氧化硅与氢氧化钠溶液反应生成硅酸钠:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
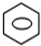 +HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$
+HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$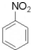 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗相同质量的硫酸 | B. | 消耗相同质量的锌 | ||
| C. | 消耗相同质量的氧化铜 | D. | 生成的硫酸锌质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锡铁制品镀层破损后铁不易被腐蚀 | |
| B. | 相同温度下,pH相同的盐酸和硫酸中水的电离程度相同 | |
| C. | 向饱和石灰水中滴加少量CuC12溶液出现蓝色沉淀,则Ksp[Ca(OH)2]<Ksp[Cu(OH)2] | |
| D. | 合成氨生产中,需将NH3液化分离,目的是加快正反应速率,并提高H2转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com