
| A、加入AgNO3溶液和稀HNO3,看是否有浑浊出现 |
| B、加入BaCl2溶液和稀HCl,看是否有浑浊出现 |
| C、先加过量的BaCl2溶液和稀HNO3,取上层清液再加AgNO3溶液,看是否有浑浊出现 |
| D、先加过量的Ba(NO3)2溶液和稀HNO3,取上层清液再加AgNO3溶液,看是否有浑浊出现 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、步骤I中搅拌的目的是使碘化铅充分溶解 |
| B、步骤II中观察到的现象是产生黄色沉淀 |
| C、此实验温度下,PbI2的溶度积常数Ksp=1.350×10-8 |
| D、若步骤I 盛装滤液的烧杯中有少量的水,Ksp的测定结果不受影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别加热,观察是否有气体产生 |
| B、分别溶于水,加Ba(OH)2溶液观察是否有沉淀产生 |
| C、分别溶于水,滴加CaCl2溶液,观察是否有沉淀生成 |
| D、分别溶于水,通入CO2观察是否有NaHCO3产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 操作 | 现象 |
| (1) | 25℃时,用pH试纸检验 | 溶液pH大于7 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得的水溶液中加入稀HNO3和Ba(NO3)2溶液 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入稀HNO3和AgNO3溶液 | 有白色沉淀产生 |
| A、肯定含有的离子是Na+、SO32-、Br-、Cl- |
| B、肯定含有的离子是SO32-、Br-、Cl- |
| C、不能确定的离子是Na+、Cl-、SO42- |
| D、不能确定的离子是Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
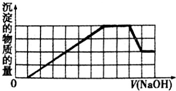 某溶液中可能含有H+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示.下列说法正确的是( )
某溶液中可能含有H+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示.下列说法正确的是( )| A、原溶液中含有的阳离子只有H+、Fe3+、Al3+ |
| B、原溶液中一定不含有SO42- |
| C、原溶液中含有的Fe3+和Al3+的物质的量之比为l:l |
| D、反应最后形成的溶液中溶质只有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2使湿的红色布条褪色是因为HClO有漂白性 |
| B、合成纤维和光导纤维都是无机非金属材料 |
| C、纯碱、烧碱、漂白粉都属于盐类 |
| D、4.0g NaOH固体中所含分子数为0.1NA(NA表示阿伏加德罗常数的值) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com