
| A. | 在钠、钾、铷三种单质中,钠的熔点最高 | |
| B. | 所有碱金属均为银白色 | |
| C. | 同一主族卤素单质从上到下熔沸点依次升高 | |
| D. | 液溴易挥发,可以通过水封的方式进行保存 |
分析 A.碱金属元素中,其单质的熔沸点与原子序数成反比;
B.碱金属元素单质中Cs略带金色光泽;
C.同一主族卤素单质其熔沸点随着原子序数增大而升高;
D.液溴易挥发,但不易溶于水,且密度大于水.
解答 解:A.碱金属元素中,其单质的熔沸点与原子序数成反比,所以在钠、钾、铷三种单质中,钠的熔点最高,故A正确;
B.碱金属元素单质中Cs略带金色光泽,其它碱金属单质呈银白色,故B错误;
C.分子晶体熔沸点与其相对分子质量成正比,所以同一主族卤素单质其熔沸点随着原子序数增大而升高,故C正确;
D.液溴易挥发,但不易溶于水,且密度大于水,所以液溴易挥发,可以通过水封的方式进行保存,故D正确;
故选B.
点评 本题考查元素周期律,为高频考点,涉及同一主族元素单质熔沸点、颜色变化规律,金属晶体熔沸点与金属键有关、分子晶体熔沸点与分子间作用力有关,题目难度不大.


科目:高中化学 来源: 题型:解答题
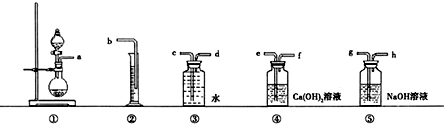
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
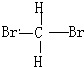 和
和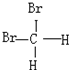 E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4
E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期 IA族 | B. | 第二周期 VIIA族 | C. | 第三周期 IA族 | D. | 第三周期 VIIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤潮、白色污染、绿色食品都与相关物质的颜色有关 | |
| B. | 地震发生后,灾区急需大量消毒剂,其中SO2可用于环境消毒 | |
| C. | 利用太阳能等清洁能源代替化石燃料,有利于节约能源,保护环境 | |
| D. | 电池一定要回收利用,主要是为了避免浪费 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
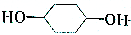 的路线如下图所示.
的路线如下图所示.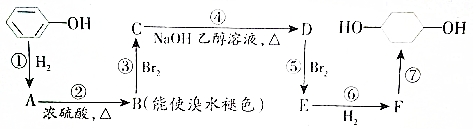
 ,F
,F .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
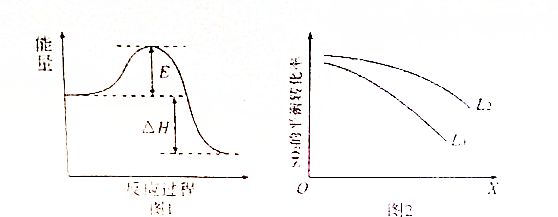
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com