
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 2:3 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 3:4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如果烧杯中最初装入的是500mL 2mol•L-1的稀硫酸溶液,构成铜锌原电池(见图,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol•L-1,c(ZnSO4)=1mol•L-1.
如果烧杯中最初装入的是500mL 2mol•L-1的稀硫酸溶液,构成铜锌原电池(见图,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol•L-1,c(ZnSO4)=1mol•L-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 越活泼的金属越难冶炼 | |
| B. | 合金的性质与其成分金属的性质不完全相同 | |
| C. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 | |
| D. | 工业上金属Mg、Al都是用电解其熔融的氯化物制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 磁性氧化铁与浓盐酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| C. | 氢氧化铁与氢碘酸反应:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 溴化亚铁溶液与足量氯水反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
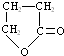 ,化合物C的结构简式是HOCH2CH=CHCOONa.
,化合物C的结构简式是HOCH2CH=CHCOONa. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 2CN-+H2O+CO2=2HCN+CO32- | |
| B. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| C. | 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-) | |
| D. | c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com