
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36。请根据下列相关信息,回答问题.
A | 基态原子最外层电子数是次外层的三倍 |
B | 基态原子核外有13种不同运动状态的电子 |
C | 与B同一周期,原子中未成对电子数是同周期中最多 |
D | D2-的核外电子排布与氩原子相同 |
E | 是ds区原子序数最小的元素 |
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列: (用相应的元素符号表示)。A、D两种元素中,电负性A D (填“>”或“<”)
(2)A3分子的空间构型为 ,与其互为等电子体的分子为 ;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是: ,
C7H15OH 中采用sp3杂化的原子共有 个;
(4)【E(NH3)4】2+配离子中存在的化学键类型有 (填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E (NH3)4】2+具有对称的空间构型.且当【E (NH3)4】2+中的两个NH3分子被两个Cl一取代时.能得到两种不同结构的产物,则【E (NH3)4】2+的空间构型为 (填序号)。
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为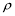 g/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式 。(用M、r、
g/cm3 (1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式 。(用M、r、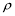 表示)
表示)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年山东省临沂市高一下学期期中考试化学试卷(解析版) 题型:选择题
汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是( )
A.减小压强能增大反应速率 B.增大压强能减小反应速率
C.使用适当的催化剂能增大反应速率 D.升高温度对反应速率无影响
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三模拟考试二理综化学试卷(解析版) 题型:选择题
四种短周期元素X、Y、Z、W,已知X、Y的阳离子aXn+、bY(n+1)+电子层结构与Z、W的阴离子cZm-、dW(m+1)-电子层结构相同。下列叙述正确的是
A.最高价氧化物对应水化物的碱性大小顺序一定是:X>Y
B.离子半径和原子半径由大到小的顺序均为X>Y>Z>W
C.氢化物的稳定性是Z>W;氢化物的沸点是Z<W
D.还原性Zm->W(m+1)-,氧化性Xn+>Y(n+1)+
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:填空题
中国是世界炼锌的发源地,宋应星著于明崇祯十年(1637年)的《天工开物》一书则是最早记述炼锌技术的典籍。回答下列问题:
Ⅰ.《天工开物》中有关于“升炼倭铅” 的记载:“炉甘石(碳酸锌)十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅(金属锌)也。”
(1)该炼锌工艺过程主要反应的化学方程式为 。
Ⅱ. 目前,工业上主要采用 “湿法炼锌”。以闪锌矿(主要成分为 ZnS ,含有FeS等杂质)为原料冶炼锌的工艺流程如下图所示。
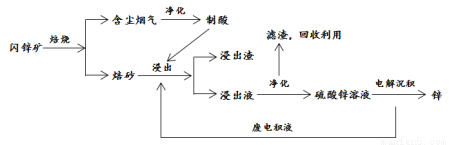
(2)闪锌矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的成分的化学式为 。
(3)焙烧过程中产生的含尘烟气可净化制酸,该酸的名称是 。
工业上常采用“针铁矿法”净化浸出液,在80~100℃,Fe3+浓度低于1g/L,调节浸出液的pH在3~5之间,溶液中的铁可以呈针铁矿(FeOOH)的形式析出。
(4)浸出液的Fe3+浓度较高,应先加入SO2或ZnS将 ,再以ZnO调节酸度,在空气缓慢氧化得 Fe3+,最后Fe3+ 转化成针铁矿沉淀。Fe2+沉淀过程的总离子方程式为 。
(5)电解沉积锌是以Pb-Ag合金惰性电极作阳极、纯铝板作阴极,通以直流电,在 上析出金属锌,电解过程的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:选择题
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO、MnO、CO32-、SO42-中的若干种组成,取该溶液进行如下实验:
① 取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液;
② 在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据对上述实验的分析判断,最后得出的结论合理的是( )
A.不能判断溶液中是否存在SO42- B.溶液中一定不存在的离子是CO32-
C.不能判断溶液中是否存在Ag+ D.不能判断是否含有 AlO 离子
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三全真模拟理综化学试卷(解析版) 题型:选择题
洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为 ( )
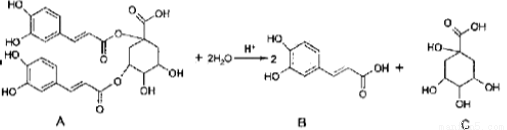
下列说法不正确的是( )
A.1mol A和足量NaOH溶液反应,最多消耗11molNaOH
B.A在一定条件下能发生取代反应、加成反应和消去反应
C.B能和浓溴水发生反应,1mol B最多消耗4 molBr2
D.C分子中含有手性碳原子
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市、沙市五中高考模拟理综化学试卷(解析版) 题型:填空题
【化学—选修5:有机化学基础】H可作为溶剂,用于制造油漆、粘合剂和除漆剂等。下图是合成H和高聚物M的一种合成路线:
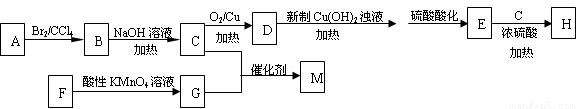
已知以下信息:
①A的产量可以用来衡量一个国家的石油化工发展水平。
②H分子结构中含有六元环。
③烃F相对分子质量为106,可以使酸性高锰酸钾溶液褪色,但不能使溴的CCl4溶液褪色。
④核磁共振氢谱显示F分子结构中只有两种化学环境的氢。
⑤ ;
;
回答下列问题:
(1)由C生成D的化学方程式为 ,反应类型为
(2)H的化学名称是 ,由C、G生成M的化学方程式:
(3)F的结构简式为
(4)同时满足下列条件G的同分异构体有 种(不考虑立体异构)。
①能与Na2CO3溶液反应生成无色无味气体
②遇FeCl3溶液发生显色反应
其中核磁共振氢谱中有4组峰,且面积比为1:2:2:1的结构简式是_______。
(5)上述由F的同分异构体X经如下步骤可合成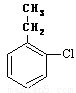 。
。
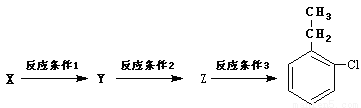
反应条件1所选择的试剂为 ;反应条件2所选择的试剂为 ;Z的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
下图为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述中不正确的是( )

A.a电极是负极
B.b电极的电极反应式为4OH-4e-=2H2O+O2↑
C.在电池内部,H+向b电极附近运动
D.氢氧燃料电池是一种具有广泛应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中理科化学试卷(解析版) 题型:选择题
已知溶液中可发生反应:2FeBr2+Br2=2FeBr3,现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl-和Br- 的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A.2mol•L-1 B.1mol•L-1 C.0.4mol•L-1 D.0.2mol•L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com