
| A. | 质量数202 | B. | 核外电子数202 | C. | 原子序数78 | D. | 核内有124个中子 |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:填空题
 ;
;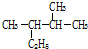 用系统命名法命名为2,3-二甲基戊烷;
用系统命名法命名为2,3-二甲基戊烷;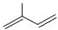 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
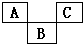 如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答:
如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答: ;B的最高价氧化物对应化物的化学式为H2SO4.
;B的最高价氧化物对应化物的化学式为H2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | B>D>C>A | C. | C>A>B>D | D. | A>C>D>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:
某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com