
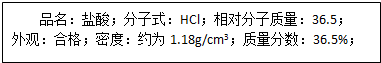
| 1000ρw |
| M |
| V |
| Vm |
| 1000×1.18×36.5% |
| 36.5 |
| x L |
| 22.4L/mol |
| x |
| 22.4 |
| x |
| 22.4 |
| 36.5x |
| 22.4 |
| 36.5x |
| 22.4 |
| 36.5x |
| 22.4 |


科目:高中化学 来源: 题型:
| A、陶瓷史人类应用很早的硅酸盐材料 |
| B、实验室中浓硝酸应保存在带有橡胶塞的无色玻璃瓶中 |
| C、高温下铁可以和水蒸气反应,生成红褐色的Fe(OH)3 |
| D、Na2O2具有强氧化性,具有杀菌能力,可用于饮用水的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 |
| B、用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 |
| C、用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 |
| D、油脂在酸性或碱性条件下均可发生水解反应,且产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
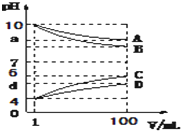 A、B、C、D是由下面的一种阳离子和一种阴离子组成的化合物(阳离子:NH4+、Na+、H+,阴离子:Cl-、CH3COO -、OH-),在水溶液中A、D能促进水的电离,B、C能抑制水的电离.常温下各物质从1mL稀释到100mL,pH的变化如图Ⅰ所示,请回答:
A、B、C、D是由下面的一种阳离子和一种阴离子组成的化合物(阳离子:NH4+、Na+、H+,阴离子:Cl-、CH3COO -、OH-),在水溶液中A、D能促进水的电离,B、C能抑制水的电离.常温下各物质从1mL稀释到100mL,pH的变化如图Ⅰ所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com