
【题目】硅烷是一种无色、与空气反应并会引起窒息的气体.其分子结构和![]() 相似,但
相似,但![]() 键键能比
键键能比![]() 键键能低。下列判断错误的是
键键能低。下列判断错误的是
A.![]() 分子呈正四面体形
分子呈正四面体形
B.![]() 分子是非极性分子
分子是非极性分子
C.因为![]() 键键能比
键键能比![]() 键键能低,所以
键键能低,所以![]() 沸点低于
沸点低于![]() 沸点
沸点
D.![]() 分子稳定性低于
分子稳定性低于![]() 分子,因为
分子,因为![]() 键键能高
键键能高
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )

A. ①为N![]() N的断裂过程
N的断裂过程
B. ①②③在高温区发生,④⑤在低温区发生
C. ④为N原子由Fe区域向Ti-H区域的传递过程
D. 使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数,下列说法正确的是( )
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.某温度下,2L密闭容器中加入4mol A和2mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=
4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=![]()
C.温度一定时,当溶液中c(Ag+ )· c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液
D.难溶电解质AB2饱和溶液中,c(A2+ )=x mol·L﹣1,c(B—)=y mol·L﹣1,则Ksp值为4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知浓硝酸和乙胺反应:![]() ,产物
,产物![]() 的熔点为
的熔点为![]() ,在室温下能够融化电离出
,在室温下能够融化电离出![]() 和
和![]() 离子,称为室温离子.下列有关正确的是
离子,称为室温离子.下列有关正确的是![]()
A.浓硝酸和乙胺反应属于加成反应
B.室溫离子可以使熔盐燃料电池在常溫下工作
C.![]() 中,只有
中,只有![]() 键没有
键没有![]() 键
键
D.融化![]() 晶体需要破坏分子间作用力
晶体需要破坏分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,固定容积的密闭容器中反应2NO2(g)![]() O2(g)+2NO(g)ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是( )
O2(g)+2NO(g)ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是( )

A.当X表示压强时,Y表示NO2的转化率
B.当X表示温度时,Y表示O2的物质的量
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________。
(2)工业上常用CO和H2合成甲醇,反应方程式为:CO(g) +2H2(g)![]() CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。
CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与n(H2)/n(CO)的关系如图1所示。

①当起始n(H2)/n(CO)=2,经过5 min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5 min内平均反应速率v(H2)=________。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH(g),达新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图像中的____点(填“D”“E”或“F”)。
③由图2可知该反应的ΔH________0(填“>”“<”或“=”),理由是______________;当压强为p2时,在y点:v正________v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应aA+bB![]() cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )
cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )

A. 该反应在T1、T3温度时达到过化学平衡
B. 该反应在T2温度时达到过化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离方程式是H2O![]() H++ OH-。下列叙述正确的是( )
H++ OH-。下列叙述正确的是( )
A.升高温度,KW增大,pH不变
B.向水中加入少量硫酸,c(H+)增大,KW不变
C.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,它性能稳定,供应充足,铝—空气电池具有能量密度高、工作原理简单、成本低、无污染等优点。铝—空气电池工作原理示意图如图:
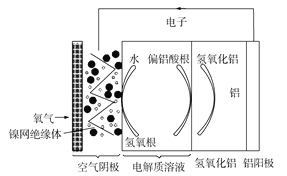
下列说法错误的是( )
A.若是碱性电解质溶液中,则电池反应的离子方程式为:4Al+3O2+4OH=4![]() +2H2O
+2H2O
B.若是中性电解质溶液中,则电池反应的方程式为:4Al+3O2+6H2O=4Al(OH)3
C.如果铝电极纯度不高,在碱性电解质溶液中会产生氢气
D.若用该电池电解氯化钠溶液(石墨作电极),当负极减少5.4g时,阳极产生6.72L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com