
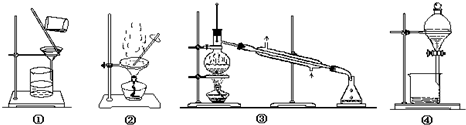
| A. | 用工业酒精制无水乙醇选择装置③ | B. | 提纯含砂石的粗苯甲酸选择装置①② | ||
| C. | 从溴水中提纯溴选择装置④ | D. | 苯中混有少量溴苯选择装置③ |
分析 A.可用蒸馏的方法精制无水乙醇;
B.提纯含杂质的粗苯甲酸,选择重结晶法;
C.从溴水中提纯溴,选择萃取法;
D.苯和溴苯的沸点不同.
解答 解:A.提纯含杂质的工业酒精,利用蒸馏法,则选择装置③,故A正确;
B.提纯含杂质的粗苯甲酸,因苯甲酸的溶解度随着温度的升高而升高,加热后缓慢降温会使其析出颗粒较大的晶体,所以常可以采用重结晶法的方法来提纯苯甲酸,需要加热溶解、趁热过滤、冷却结晶、滤出晶体等操作提纯苯甲酸,故B错误;
C.从溴水中提纯溴,选择萃取法,则选择装置④,故C正确;
D.苯和溴苯的沸点不同,可用蒸馏的方法分离,故D正确;
故选B.
点评 本题考查混合物分离提纯方法的选择和应用,为高频考点,把握物质的性质、性质差异及分离方法和原理为解答的关键,注意装置的作用,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 负极的电极反应式为:H2-2e-+2OH-═2H2O | |
| B. | H2应从负极通入,发生还原反应 | |
| C. | 标准状况下,通入5.6 L O2并完全反应后,有0.50 mol电子转移 | |
| D. | 放电一段时间后,通入O2的电极附近溶液的pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶 | |
| B. | 煤的主要成分是单质碳、苯、二甲苯等,可通过煤的干馏将它们分离 | |
| C. | 聚氯乙烯塑料可制作保鲜膜、一次性食品袋 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
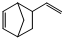 异构化可得到三元乙丙橡胶的第三单体
异构化可得到三元乙丙橡胶的第三单体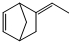 .
. 由A(C5H6)和B经Diels-Alder反应制得.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是
由A(C5H6)和B经Diels-Alder反应制得.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是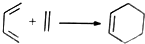 .
.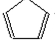 .
.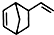 互为同分异构体,且一溴代物只有两种的芳香烃的名称:1,3,5-三甲基苯;写出生成这两种一溴代物所需要的反应试剂和反应条件:催化剂和液溴、光照和溴蒸气.
互为同分异构体,且一溴代物只有两种的芳香烃的名称:1,3,5-三甲基苯;写出生成这两种一溴代物所需要的反应试剂和反应条件:催化剂和液溴、光照和溴蒸气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |
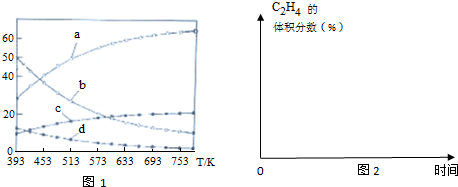
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A. | 溶液的质量减小程度:乙<甲 | |
| B. | 溶液的导电能力变化:甲>乙 | |
| C. | 甲中阴极和乙中镁电极上析出物质质量:甲=乙 | |
| D. | 电极反应式:甲中阳极:2Cl--2e→Cl2↑,乙中正极:Cu2++2e→Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com