
����Ŀ��������2013��12��ĩ���й������������װ�������ﵽ10.66GW����������ۼ�װ�������ﵽ17.16GW��������ͼΪ�����������װ�ã���ͼΪ�������[CO(NH2)2]�ļ�����Һ�����װ��ʾ��ͼ�������и�Ĥ����ֹ����ͨ��������������Ϊ���Ե缫����������������ȷ����
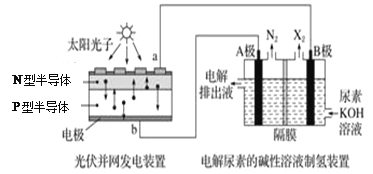
A. ��ͼ��N�Ͱ뵼��Ϊ������P�Ͱ뵼��Ϊ����
B. ��ͼ��Һ�е�������Ϊ��B����������A������
C. X2����
D. ����ʱ��A���ĵ缫��ӦʽΪCO(NH2)2+8OH-��6e-=CO32-+N2��+6H2O
���𰸡�D
��������A���ͼΪ�����������װ�ã���ͼΪ�������[CO(NH2)2]�ļ�����Һ�����װ������װ�ù���ʱ����Ԫ�ػ��ϼ���-3�۱�Ϊ0�ۣ�HԪ�ػ��ϼ���+1�۱�Ϊ0�ۣ���Ԫ�ر���������Ԫ�ر���ԭ���������ɵ����ĵ缫A�����������������ĵ缫B������������ͼ��N�Ͱ뵼��Ϊ������P�Ͱ뵼��Ϊ��������A����B����ʱ�����ӵ�����Ϊ������(A��)����Դ����Դ������(B��)����B����C�����B�Ϸ�����ԭ��Ӧ���缫��ӦʽΪ2H2O+2e-=H2��+2OH-������X2ΪH2����C����D�A��Ϊ������CO(NH2)2����������Ӧ����N2���缫��ӦʽΪ��CO(NH2)2+8OH--6e-=CO32-+N2��+6H2O����D��ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������4���л��������У��ܹ������������ӳɺ�����3�ַ�Ӧ���ǣ� �� ��CH2=CHCOOH ��CH2=CHCOOCH3 ��CH2=CHCH2OH ��CH3CH2CH2OH�� ![]()
A.�٢ۢ�
B.�ڢ�
C.�٢ۢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���У�û����ɫ�仯����
A.��������Һ�����Ƶ�Cu(OH)2����Һ��ϼ���
B.������Һ�м�����
C.�������м���Ũ����
D.������Һ�м���ϡ���Ტ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г�������ʵ�����A��B��һ���¶��·�����ӦA��g��+xB��g��2C��g�����ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı�Ӱ�췴Ӧ��һ��������������������ʵ����ʵ���Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯��ͼ��ʾ������˵������ȷ���ǣ� �� 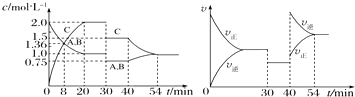
A.30��40 min��÷�Ӧʹ���˴���
B.��Ӧ����ʽ�е�x=1������ӦΪ���ȷ�Ӧ
C.30 minʱ�����¶ȣ�40 minʱ�����¶�
D.8 minǰA�ķ�Ӧ����Ϊ0.08 molL��1min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij̽��С�����ñ�ͪ�������Ӧ(CH3COCH3��Br2![]() CH3COCH2Br��HBr)���о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ���� v(Br2) ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
CH3COCH2Br��HBr)���о���Ӧ��Ũ���뷴Ӧ���ʵĹ�ϵ����Ӧ���� v(Br2) ͨ���ⶨ�����ɫ��ʧ�����ʱ����ȷ������һ���¶��£��������ʵ�����ݣ�
ʵ����� | ��ʼŨ��c/mol��L��1 | ����ɫ��ʧ����ʱ��t/s | ||
CH3COCH3 | HCl | Br2 | ||
�� | 0.80 | 0.20 | 0.0010 | 290 |
�� | 1.60 | 0.20 | 0.0010 | 145 |
�� | 0.80 | 0.40 | 0.0010 | 145 |
�� | 0.80 | 0.20 | 0.0020 | 580 |
����ʵ���������ó��Ľ�������ȷ����(����)
A������c(CH3COCH3)��v(Br2)����
B��ʵ��ں͢۵�v(Br2)���
C������c(HCl)��v(Br2)����
D������c(Br2)��v(Br2)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������SO2�������Ƿ����CO2���壬�ɲ��õķ����ǣ� ��
A.ͨ��HNO3�ữ��Ba��NO3��2��Һ
B.��ͨ������Ʒ����Һ����ͨ������ʯ��ˮ
C.��ͨ������NaOH��Һ����ͨ������ʯ��ˮ
D.��ͨ����������KMnO4��Һ����ͨ������ʯ��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ������е�������a.�д̼�����ζ��b.����ˮ��Ӧʹ��Һ�����ԣ�c.��ʹ���۵⻯����Һ���������и��������������ȫ���������ǣ� ��
A.NO2��SO2B.NH3��NO2C.NO2��Cl2D.Cl2��SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO��g��+2H2��g��![]() CH3OH��g�� ��H1
CH3OH��g�� ��H1
��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H2
CH3OH��g��+H2O��g�� ��H2
��CO2��g��+H2��g��![]() CO��g��+H2O��g�� ��H3
CO��g��+H2O��g�� ��H3
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼�����H1=______����֪��H2=��58 kJmol-1������H3=______��
��2���ϳ����е������Ƿ�չ�е�����Դ���������ð����Ʊ��������Ӧ���������ڡ���������ȣ�������Ϊȼ�ϵ��ŵ���__________________________________________________________��д�����㣩��ȱ����______________________________________________________________________��д�����㣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��������֪���ʵ���Ũ��Ϊ0.1000mol/L��NaOH��Һ���ⶨδ֪���ʵ���Ũ�ȵ����ᣬѡ���̪��ָʾ��������д���пհף�![]()
��1����ͼ������������ ��
��2���ñ�������������Һ�ζ����������ʱ�����ּ�ѹ��Ƥ���в���С������ҡ����ƿ���۾�ע�� �� �ζ��յ���жϷ����� ��
��3����������������ݣ��ɼ�����������Ũ��ԼΪ��������λ��Ч���֣���
ʵ�� | NaOH��Һ�� | �ζ����ʱ����Һ��������/mL aOH | �����ε����/mL�� |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
��4��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ��� ��
A.�ζ��յ����ʱ���Ӷ���
B.��ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô������ᡢ��ϴ
C.��ƿˮϴ��δ����
D.��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com