
| A、化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关 |
| B、盖斯定律遵守能量守恒定律 |
| C、利用盖斯定律可间接计算通过实验难测定的反应的反应热 |
| D、利用盖斯定律可以计算有副反应发生的反应的反应热 |


科目:高中化学 来源: 题型:
| 阳离子 | Fe3+、Ba2+、Al3+、Na+、Ag+ |
| 阴离子 | NO3-、OH-、SO42-、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校化学兴趣小组的同学用如图装置进行实验,已知分液漏斗、小试管中均盛有水.请回答下列问题:
某校化学兴趣小组的同学用如图装置进行实验,已知分液漏斗、小试管中均盛有水.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积 |
| B、溶度积常数是不受任何条件影响的常数,简称溶度积 |
| C、可用离子积Qc判断沉淀溶解平衡进行的方向 |
| D、所有物质的溶度积都是随温度的升高而增大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 3.00 | 2.25 | 1.75 | 1.36 | 1.00 | 1.00 |
| c(CO)/×10-4mol?L-1 | 4.00 | 3.25 | 2.75 | 2.36 | 2.00 | 2.00 |
| 实验编号 | T/℃ | NO初始浓度mpl?L-1 | CO初始浓度mpl?L-1 | 催化剂的比表面积m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | a | 1.20×10-3 | c | 124 |
| Ⅲ | 350 | b | 5.80×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、488.3kJ?mol-1 |
| B、-244.15kJ?mol-1 |
| C、244.15kJ?mol-1 |
| D、-488.3kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
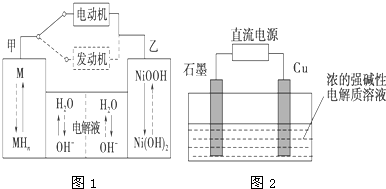 运用相关原理,回答下列问题:
运用相关原理,回答下列问题:| 1 |
| 2 |
| 3 |
| 2 |
| 放电 |
| 充电 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将一定量氨气通入0.1 mol?L-1 NH4Cl溶液中可能有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、AgCl沉淀易转化成AgI沉淀且Ksp(AgX)=c(Ag+)?c(X-),故Ksp(AgI)>K(AgCl) |
| C、F、Cl、Br、I的非金属性逐渐减弱,HF、HCl、HBr、HI水溶液的酸性逐渐减弱 |
| D、短周期元素形成离子后,最外层均达8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com