
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
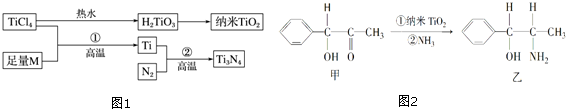
分析 ①Ti原子核外电子数为22,根据能量最低原理书写Ti3+核外电子排布式,确定Ti3+未成对电子数;与Ti同族下一周期元素质子数相差18,即Zr的质子数为40,据此书写其外围电子排布式,钛元素最高化合价为Ti3+再失去未成对电子数形成的化合价;
②M是短周期金属元素,M的第三电离能剧增,处于ⅡA族,能与TiCl4反应置换出Ti,则M为Mg,Mg晶体属于六方最密堆积;
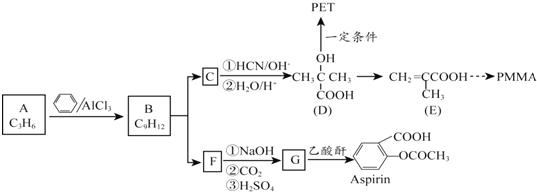
③采取sp2杂化的碳原子价层电子对数是3,采取sp3杂化的原子价层电子对数是4,乙中采取sp3杂化的原子有C、N、O,同一周期元素中,元素的电负性随着原子序数的增大.
解答 解:①Ti为22号元素,原子核外电子排布为1s22s22p63S23p63d24s2,基态Ti3+的核外电子排布式为1s22s22p63s23p63d1,3d1其未成对电子数是1,与Ti同族下一周期元素质子数相差18,即Zr的质子数为40,Zr的基态原子的电子排布式为1s22s22p63S23p63d104s24p64d25s2,外围电子排布式为:4d25s2,钛元素最高化合价为Ti3+再失去1个未成对电子,为+4价,
故答案为:1;4d25s2;+4;
②M是短周期金属元素,M的第三电离能剧增,处于ⅡA族,能与TiCl4反应置换出Ti,则M为Mg.Mg晶体属于六方最密堆积,
故答案为:Mg;六方最密堆积;
③化合物甲的分子中采取sp2杂化的碳原子为苯环上的六个、羰基中的一个,共7个;采取sp3杂化的原子价层电子对数是4,乙中采取sp3杂化的原子有C、N、O,同一周期元素中,元素电负性随着原子序数依次增加电负性逐渐增大,所以它们的电负性关系为:O>N>C,
故答案为:7; O>N>C.
点评 本题考查物质结构和性质,涉及核外电子排布、杂化方式、电离能、晶体结构等,注意理解电离能与最外层电子数关系,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、CO32-、Br-、ClO-能大量共存 | |
| B. | 不能用稀硝酸酸化的硝酸钡溶液检验该溶液是否变质 | |
| C. | 将此溶液与稀硫酸产生的少量气体通入足量的NaAlO2溶液中制Al(OH)3:2AlO2-+SO2+3H2O═2Al(OH)3↓+SO32- | |
| D. | 能使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
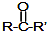 $→_{②H_{2}O/H+}^{①HCN/OH-}$
$→_{②H_{2}O/H+}^{①HCN/OH-}$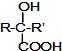
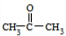 .
.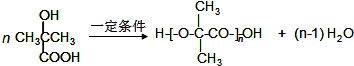 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
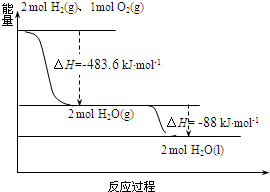
| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量高 | |
| B. | 氢气燃烧的反应为放热反应,故H2与O2混合即可自发进行 | |
| C. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-571.6 kJ•mol-1 | |
| D. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段 时间后,溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Al产生H2的溶液中:Cl-、Na+、NO3- | |
| B. | 在某酸性透明的溶液中:Fe2+、H+、I- | |
| C. | 滴加KCSN试剂呈红色的溶液中:K+、SO32-、HCO3- | |
| D. | 在由水电离出的c(H+)×c(OH-)=1×10-24的溶液中:SO42-、F-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇、乙醇、氨气等都是重要的化工原料.
甲醇、乙醇、氨气等都是重要的化工原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com