
分析 通入足量石灰水生成的沉淀为碳酸钙,根据碳酸钙的质量可以计算出碳酸钙的物质的量,根据C原子守恒计算出甲中含有的C原子数,测得在同温、同压、同体积时B的质量是H2质量的14倍,根据m=nM可知,该B的摩尔质量为氢气的14倍,据此可以计算出甲的摩尔质量,相同条件下A与B的蒸汽密度比等于其摩尔质量之比,可知A的摩尔质量为B的摩尔质量的2倍,然后计算出5.6gA的物质的量,根据摩尔质量计算出分子式,根据分子式确定结构简式,结合有机物的性质分析.
解答 解:(1)5.6该烃完全燃烧后生成的气体通入足量的石灰水,得到40克沉淀,沉淀为碳酸钙,其物质的量为:$\frac{40g}{100g/mol}$=0.4mol,根据质量守恒,5.6g该烃中含有C的物质的量为0.4mol;
在同温、同压、同体积的气体具有相同的物质的量,根据m=nM可知,B的摩尔质量是H2质量的14倍,B的摩尔质量为:2g/mol×14=28g/mol,
5.6g甲的物质的量为:n=$\frac{5.6g}{28g/mol}$=0.2mol,
B中含有碳原子数为:$\frac{0.4mol}{0.2mol}$=2,
则B分子中含有H的数目为:$\frac{28-12×2}{1}$=4,
该B的分子式为C2H4,为乙烯;
测得A与B在相同状况下蒸气密度比为 2:1,可知A的摩尔质量为B的摩尔质量的2倍,则A的摩尔质量为28g/mol×2=56g/mol,
5.6gA的物质的量为$\frac{5.6g}{56g/mol}$=0.1mol,
A中含有碳原子数为$\frac{0.4mol}{0.1mol}$=4,
则A中所含H的数目$\frac{56-12×4}{1}$=8,
则A的分子式为C4H8,
故答案为:C4H8;C2H4;
(2)B为C2H4,C2H4没有同分异构体;A为C4H8,其同分异构体为:CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2,名称分别为:1-丁烯,2-丁烯,2-甲基-1-丙烯;
故答案为:C4H8;1-丁烯;2-丁烯;2-甲基-1-丙烯;
(3)乙烯含有碳碳双键,与溴发生加成反应,化学方程式为:CH2=CH2+Br2→CH2Br-CH2Br,故答案为:CH2=CH2+Br2→CH2Br-CH2Br.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握常见有机物结构与性质,能够根据质量守恒、烃的燃烧通式计算有机物的分子式、结构简式,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
 2015年12月11日瑞典斯德哥尔摩诺贝尔奖颁奖典礼举行,授予中国女药学家屠呦呦、美国科学家威廉•坎贝尔和日本大村智诺贝尔医学奖,以表彰他们在寄生虫疾病治疗方面取得的成就.屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图,下列说法错误的是( )
2015年12月11日瑞典斯德哥尔摩诺贝尔奖颁奖典礼举行,授予中国女药学家屠呦呦、美国科学家威廉•坎贝尔和日本大村智诺贝尔医学奖,以表彰他们在寄生虫疾病治疗方面取得的成就.屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图,下列说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素是芳香族化合物 | ||
| C. | 青蒿素可以发生水解反应 | D. | 青蒿素含有过氧结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
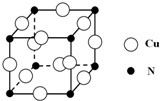 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: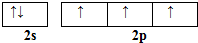 .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.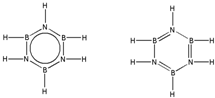 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3和KOH | B. | Na2CO3和盐酸 | C. | NaAl(OH)4和盐酸 | D. | AlCl3和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.10 mol•L-1的醋酸钠溶液20mL与0.10 mol•L-1盐酸10mL混合后溶液显酸性:c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH) | |
| B. | pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-)=c (H+)=c(OH-) | |
| C. | 若0.10 mol•L-1的醋酸的pH=a,0.010 mol•L-1的醋酸的pH=b,则a+1>b | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO>H2CO3 | B. | 电负性:N>O>C | ||
| C. | 晶体熔点的高低: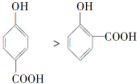 | D. | 稳定性:H2O<NH3<PH3<SiH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com