
【题目】将3g下列各组内两种金属的混合物投入水中,若收集到0.1g氢气,则此种混合物不可能是( )
A.Li和Na
B.Rb和Ca
C.Na和Cu
D.K和Na
【答案】A
【解析】解:n(H2)= ![]() =0.05mol,令金属与盐酸反应都是+1价,根据转移电子守恒得n(金属)=2n(H2)=2×0.05mol=0.1mol,则混合金属的平均摩尔质量=
=0.05mol,令金属与盐酸反应都是+1价,根据转移电子守恒得n(金属)=2n(H2)=2×0.05mol=0.1mol,则混合金属的平均摩尔质量= ![]() =30g/mol,则平均相对原子质量为30,因为没有金属相对原子质量为30的,所以两种金属一种相对原子质量大于30、一种相对原子质量小于30,
=30g/mol,则平均相对原子质量为30,因为没有金属相对原子质量为30的,所以两种金属一种相对原子质量大于30、一种相对原子质量小于30,
A.Li、Na元素相对原子质量都小于30,所以不符合条件,故A选;
B.Rb相对原子质量大于30、+1价Ca元素(+1价时其相对原子质量为20)的相对原子质量为20,符合条件,故B不选;
C.Na元素相对原子质量小于30、+1价Cu元素相对原子质量大于30,符合条件,故C不选;
D.K的相对原子质量大于30、Na元素的相对原子质量小于30,符合条件,故D不选;
故选A.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
CrO42﹣ ![]() Cr2O72﹣
Cr2O72﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3↓
Cr(OH)3↓
己知转化过程中的反应为:2CrO42﹣(aq)+2H+(aq)═Cr2O72﹣(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣ . 下列说法不正确的是( )
A.转化过程中,增大c(H+),平衡向正反应方向移动,CrO42﹣的转化率提高
B.常温下Ksp[Cr(OH)3]=1×10﹣32 , 要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
C.若用绿矾(FeSO47H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
D.常温下转化反应的平衡常数K=104 , 则转化后所得溶液的pH=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是 ( )
A. 钠与水反应: Na +2H2O![]() Na++2OH- + H2↑
Na++2OH- + H2↑
B. 将少量Na2O2固体加入过量Ba(HCO3)2溶液中:2Na2O2+4Ba2++4HCO3-=4BaCO3↓+2H2O+O2↑+4Na+
C. 向氢氧化钡溶液中加入稀硫酸: Ba2++OH- + H+ + SO42- ![]() BaSO4↓+H2O
BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水: Ca2++ HCO3-+OH-![]() CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的概念、性质说法正确的是( )
A.苯与甲苯属于同分异构体
B.苯与液溴在FeBr3催化作用下发生的反应属于取代反应
C.甲烷与Cl2在光照条件下发生的反应属于加成反应
D.乙醇与乙二醇( CH2OH-CH2OH) 属于同系物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和苯都是重要的有机化工原料,下列有关说法正确的是( )
A.二者分子中均存在碳碳双键
B.二者均属于芳香烃
C.二者均可使酸性高锰酸钾溶液褪色
D.二者在一定条件下均能与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有____________________。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
ⅰ锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:
![]()
① 过程Ⅰ发生反应的化学方程式为______________________(SiO2+3C![]() SiC+2CO↑为副反应)若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为________________。
SiC+2CO↑为副反应)若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为________________。
②整个制备过程必须严格控制无水。SiCl4遇水剧烈水解生成两种酸,反应的化学方程式是_________________________。
ⅱ 工业上也可以通过如下图所示的流程制取纯硅:

①有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_________;SiHCl3极易水解,其完全水解的化学方程式为___________________________。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | ﹣30.4 | ﹣84.9 | ﹣111.9 |
② 假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为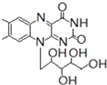 ,已知:
,已知:![]() ,有关核黄素的下列说法中,不正确的是
,有关核黄素的下列说法中,不正确的是
A. 该化合物的分子式为C17H22N4O6
B. 酸性条件下加热水解,有CO2生成
C. 酸性条件下加热水解,所得溶液加碱后有NH3生成
D. 能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用实验室制得的乙烯(C2H5OH![]() CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是

A. 装置①和装置③中都盛有水,其作用相同
B. 装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C. 产物可用分液的方法进行分离,1,2﹣二溴乙烷应从分液漏斗的上口倒出
D. 制备乙烯和生成1,2﹣二溴乙烷的反应类型分别是消去反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大.A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳.
(1)请写出B、D元素的名称:B , D .
(2)画出C元素的离子结构示意图 .
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式 .
(4)A、B、C三种元素形成的化合物的电子式为 , 所含的化学键类型为 .
(5)A、E形成化合物的结构式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com