
一定条件下将0.1mol N2和0.3mol H2置于恒容密闭容器中发生反应:N2+3H2 2NH3.下列关于该反应的说法正确的是( )
2NH3.下列关于该反应的说法正确的是( )
A.最终可生成0.2 mol NH3
B.增大压强能使反应速率减小
C.降低反应体系的温度能加快反应速率
D.向容器中再加入N2,能加快反应速率
科目:高中化学 来源: 题型:选择题
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用pH试纸来测定1mol•L-1硫酸溶液的pH | |
| B. | NH3可以使湿润的pH试纸变红 | |
| C. | 用广泛pH试纸测定某氢氧化钠溶液的pH为12.5 | |
| D. | 用干燥洁净的玻璃棒蘸取待测液,滴到pH试纸上,再和标准比色卡对照 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)  4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变
4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变 化关系如图.下列说法正确的是( )
化关系如图.下列说法正确的是( )

①若当温度升高后,则图中θ>45°
②若再加入B,则正、逆反应速率均逐渐增大
③若再加入B,则再次达到平衡时反应体系气体密度不变
④平衡时B的转化率为50%
A.①③ B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
在25℃、1.01×105 Pa下,反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJ•mol﹣1能自发进行的合理解释是( )
A.该反应是分解反应 B.该反应的熵增效应大于焓变效应
C.该反应是熵减反应 D.该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
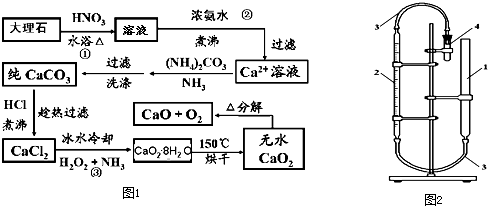
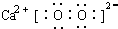 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分离花生油和NaCl溶液混合液,选④ | B. | 用CC14提取碘水中的碘,选③ | ||
| C. | 用NaOH溶液吸收CO中混有的CO2选⑤ | D. | 粗盐提纯,选①和② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com