


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、易被强氧化剂KMnO4等氧化 |
| B、属于不饱和烃易发生加成反应 |
| C、属于不饱和烃但比较易发生取代反应 |
| D、苯是一种重要的有机溶剂可广泛应用于生产绿色油漆等 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 试剂1 | 试剂2 | 溶解后温度/℃ | 静止后温度/℃ | 试剂3 | 混合后温度/℃ |
| 0.5g碳酸钠 | 10mL 19.0℃的水 | 22.3 | 19.0 | 10mL 19.0℃的盐酸(20%) | 22.7 |
| 0.5g碳酸氢钠 | 10mL 19.0℃的水 | 17.5 | 19.0 | 10mL 19.0℃的盐酸(20%) | 18.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温高压 |
| 催化剂 |
容器 |
甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol?L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度/g?L-1 | ρ1 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
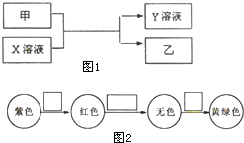 甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y是化合物.X溶液呈淡绿色.它们之间有如图1所示转化关系.
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y是化合物.X溶液呈淡绿色.它们之间有如图1所示转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 预期实验目的或结论 |
| A | 室温下,用pH试纸测定浓度为0.1mol?L-1 Na2SiO3溶液和Na2CO3溶液的pH |
比较Si和C的电负性 |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 将某气体通入淀粉和KI的混合溶液,溶液变蓝色 | 该气体一定是Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com