
分析 (1)N2(g)+3H2(g)?2NH3(g)△H=-92.38kJ•mol-1的意义为1mol氮气和3mol氢气完全反应生成2mol氨气时放出92kJ的热量,但N2(g)+3H2(g)?2NH3(g)属于可逆反应,可逆反应的特点是正、逆反应都不能进行到底,因此1 mol N2(g)和3 mol H2(g)不能完全反应生成2 mol NH3(g),因而放出的热量总小于92 kJ,依据热化学方程式计算电子转移总数为6e-放热92KJ,计算得到充分反应后转移电子的物质的量为9mol时放出的热量;
(2)反应焓变△H=反应物断裂化学键吸收的能量-生成物形成化学键放出的热量;
解答 解:(1)N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1的意义为1mol氮气和3mol氢气完全反应生成2mol氨气时放出92.38kJ的热量,但N2(g)+3H2(g)?2NH3(g)属于可逆反应,可逆反应的特点是正、逆反应都不能进行到底,因此1 mol N2(g)和3 mol H2(g)不能完全反应生成2 mol NH3(g),因而放出的热量总小于92 kJ,N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,反应进行完全电子转移为6e-放热92KJ,充分反应后转移电子的物质的量为9mol,放热138KJ,
故答案为:小于;该反应是可逆反应,在密闭容器中进行该反应将达到平衡状态,1molN2(g)和3molH2(g)不能完全反应生成2molNH3(g),因而放出的热量总小于92kJ;138KJ;
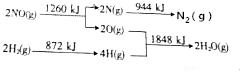
(2)转化关系中断裂NO中化学键吸收能量为1260KJ×$\frac{1}{2}$=630KJ,断裂H2中化学键吸收能量872KJ×$\frac{1}{2}$=436KJ,形成$\frac{1}{2}$N2放出能量=$\frac{1}{2}$×944KJ=472KJ,形成H2O放热=1848KJ×$\frac{1}{2}$=924KJ,则反应NO(g)+H2(g)=$\frac{1}{2}$N2(g)+H2O(g)的△H=630KJ+436KJ-(472KJ+924KJ)=-330KJ/mol,
故答案为:-330.
点评 本题考查了热化学方程式的意义和可逆反应的特点,题目难度不大,注意正确理解可逆反应热化学方程式的意义.


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥① | B. | ③④②⑤① | C. | ③②④⑥⑤① | D. | ④③⑥⑤① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 | |
| C. | 等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多 | |
| D. | 等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生CO2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等,途径a:Cu$→_{△}^{O_{2}}$CuO$?_{加热}^{稀H_{2}SO_{4}}$CuSO4;途径b:Cu$→_{△}^{浓硫酸}$CuSO4 | |
| C. | 不用其它化学试剂只用适当仪器就可以区别NaCO3溶液和稀硫酸 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以利用该反应检验Mn2+ | |
| B. | 配平后的系数为2、5、8、2、10、16 | |
| C. | 该反应中酸性介质不能为盐酸 | |
| D. | 若有0.1mol还原产物生成,则转移电子0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由蛋白质得到氨基酸、由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br-═2Cl-+Br2 Zn+Cu2+═Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O═4NaOH+O2↑ Cl2+H2O═HCl+HClO | 均为水作还原剂的氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中有共价键 | |
| C. | 物质WY2、W3X4均有熔点高、硬度大的特性 | |
| D. | T元素肯定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com