
分析 (1)①、根据n=cV计算氯化钠的物质的量,再根据m=nM计算氯化钠的质量,注意天平的精确度为0.1;
②、当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切;
③、一定容量的容量瓶只能配制需要体积的溶液,将溶解后的氯化钠溶液移入100mL容量瓶内;
(2)根据溶液配制实验操作的步骤进行排序;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$判断对所配溶液浓度影响.
解答 解:(1)①、NaCl的物质的量n=cV=0.1L×1mol•L-1=0.1mol,NaCl的质量为0.1mol×58.5g/mol=5.85g≈5.9g,
故答案为:5.9;
②、当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,
故答案为:胶头滴管;
③、一定容量的容量瓶只能配制需要体积的溶液,将溶解后的氯化钠溶液移入100mL容量瓶内,
故答案为:100mL容量瓶;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2~3次,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞,反复颠倒摇匀,故正确操作顺序为①③⑤②④,
故答案为:①③⑤②④;
(3)①溶液配制需加水定容,容量瓶中原有少量蒸馏水,对所配溶液浓度无影响,
故答案为:无影响;
②定容时仰视容量瓶刻度线,溶液的液面超过刻度线,所配溶液体积偏大,故溶液浓度偏低,
故答案为:偏低;
③定容后,把容量瓶倒置摇匀后发现液面低于刻度线,少量溶液残留在瓶口与瓶塞之间,对所配溶液无影响,
故答案为:无影响.
点评 本题考查了一定物质的量浓度溶液的配制,难度不大,注意根据c=$\frac{n}{V}$理解溶液配制与误差分析.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
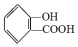 ,
,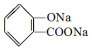 ;请写出将
;请写出将 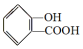 转化为
转化为 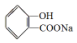 的化学方程式
的化学方程式 +NaHCO3→
+NaHCO3→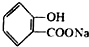 +H2O+CO2↑.
+H2O+CO2↑.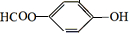
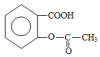 ,它与足量氢氧化钠溶液发生反应的方程式是
,它与足量氢氧化钠溶液发生反应的方程式是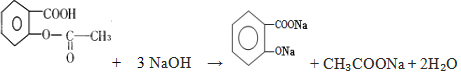 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物的分子式为C3H6O3 | B. | 该有机物分子中含有羟基和羧基 | ||
| C. | 该有机物可以发生消去反应 | D. | 该有机物可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硫酸、浓硝酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 甲苯与氯气在光照的条件下反应主要生成2,4-二氯甲苯 | |
| C. | 苯酚与浓溴水反应生成2,4,6-三溴苯酚 | |
| D. | 丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
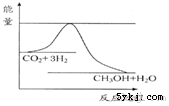 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
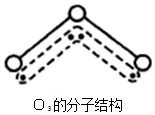 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com