
| 滴定次数 | 待测液体积/mL | 标准碘溶液体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均值 | ||
| 1 | 25.00 | 0.00 | 14.97 | ① |
| 2 | 25.00 | 0.10 | 15.13 | |
| 3 | 25.00 | 0.22 | 14.93 | |
分析 (3)②根据碘能使淀粉变蓝色选择试剂;
(4)②根据维生素C水溶液呈酸性选择滴定管;
③滴定时左手控制活塞;眼睛注视锥形瓶中溶液颜色的变化直到滴定终点;根据反应的原理,当出现溶液变蓝色时,维生素C已全部参加了反应;
(5)根据题中的数据,第3组数据偏差较大,所以消耗标准碘溶液体积为$\frac{14.97+15.03}{2}$mL=15.00mL,根据反应C6H8O6+I2→C6H6O6+2H++2I-,可以计算出橙汁中维生素C的含量;
解答 解:(3)②利用I2氧化维生素C,根据碘使淀粉显蓝色的性质,应选择淀粉作指示剂,
故答案为:淀粉;
(4)②由于维生素C的水溶液呈酸性,所以选用酸式滴定管或者移液管,
故答案为:酸式滴定管(或移液管);
③在滴定时左手控制活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化直到滴定终点;根据反应的原理,当出现溶液变蓝色时,维生素C已全部参加了反应,滴定终点现象为:最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色,
故答案为:活塞;锥形瓶中溶液颜色的变化;最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色;
(5)根据题中的数据,第3组数据偏差较大,所以消耗标准碘溶液体积为$\frac{14.97+15.03}{2}$mL=15.00mL,15ml标准碘溶液含有碘的质量为:254g/mol×0.015L×7.5×10-3mol•L-1=28.575mg
设20.0mL待测橙汁中维生素C的质量为X
C6H8O6 +I2 →C6H6O6+2H++2I-
176 254
X 28.575mg
$\frac{176}{254}$=$\frac{X}{28.575mg}$,
解得:X=19.8mg
则1L中含维生素C的质量为:19.8mg×1000ml/25ml=792mg,
所以,则此橙汁中维生素C的含量是792mg/L,
故答案为:792;
点评 本题考查物质的含量的测定,为高频考点,侧重于学生的分析、实验和计算能力的考查,属于综合实验题,完成本题时要注意题中数据的处理,合理进行误差的分析等,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol OH-中含有的电子数目为9 NA | |
| B. | 标准状况下,22.4 L乙醇含有的分子数目为 NA | |
| C. | 1 L 0.1 mol/L NH4Cl溶液中,NH4+的数目为0.1 NA | |
| D. | 0.3 mol NO2溶于水生成HNO3,转移的电子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 整个溶液变蓝色 | B. | 上层无色下层紫红色 | ||
| C. | 整个溶液显紫红色 | D. | 上层紫红色下层无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 6 | 8 | 10 |
| n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率ν(C)=0.02 mol•L-1•min-1 | |
| B. | 平衡后降低温度,反应达到新平衡前ν(逆)>ν(正) | |
| C. | 其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小 | |
| D. | 保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时电池内部Li+向正极移动 | |
| B. | 该电池不能选用水做溶剂的电解质 | |
| C. | 充电时,正极的电极反应式:0.45Li++Li0.55CoO2+0.45e-=LiCoO2 | |
| D. | 充电时,外接电源的正极与电池上标注“+”的电极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和丙烯 | B. | 甲烷和丁烯 | C. | 乙烷和乙烯 | D. | 丙烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
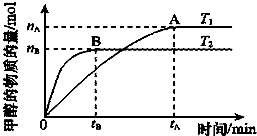 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com