
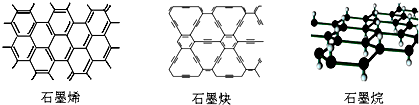
| A. | 石墨烯和石墨炔互为同素异形体 | |
| B. | 石墨炔有望替代二氧化硅用作半导体材料 | |
| C. | 12g石墨烯完全转变为石墨烷需标况下11.2L氢气 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
分析 A.同素异形体是同种元素组成的结构不同的单质;
B.石墨炔是具有优良的半导体性能,二氧化硅不是半导体材料;
C.每个C原子增加1个H原子后得到石墨烷,氢气物质的量为碳的一半,但氢气状态不确定,不能氢气体积;
D.碳原子半径大于氢原子,则石墨炔孔径大于H2分子的直径,可以容纳H2分子.
解答 解:A.同素异形体是同种元素组成的结构不同的单质,石墨烯和石墨炔都由碳组成,为不同单质,互为同素异形体,故A正确;
B.石墨炔是具有优良的半导体性能,可作半导体材料,但二氧化硅不是半导体材料,故B错误;
C.每个C原子增加1个H原子后得到石墨烷,则碳原子与H原子数目相等,氢气物质的量为碳的一半,则12g石墨烯完全转变为石墨烷需标况下11.2L氢气,故C正确;
D.碳原子半径大于氢原子,则石墨炔孔径大于H2分子的直径,可以容纳H2分子,则石墨炔是理想的H2提纯薄膜,故D正确,
故选B.
点评 本题以石墨炔为知识背景,考查了同素异形体、半导体材料等,为高频考点,侧重于考查学生阅读信息和应用信息的能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2微溶于水,所以Ca(OH)2是弱电解质 | |
| B. | 强电解质溶液的导电能力可能比弱电解质溶液导电能力弱 | |
| C. | Cu、NaCl溶液不是电解质,所以是非电解质 | |
| D. | SO3溶于水后导电,所以SO3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
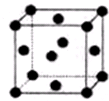 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 醋酸是日常生活中常见的弱酸.
醋酸是日常生活中常见的弱酸.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
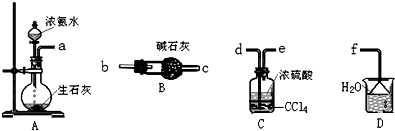
 案.
案.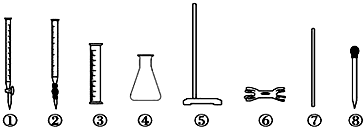
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应是吸热还是放热的,须看反应物和生成物所具有总能量的大小 | |
| B. | 放热反应在常温条件下一定很容易发生 | |
| C. | 需要加热方能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl的反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.4mol/(L•s) | D. | v(D)=0.45mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com