
| A. | 只有②④⑤ | B. | 只有①②④ | C. | 只有②④ | D. | 只有①②④⑤ |
分析 ①溴乙烷和NaOH的水溶液发生水解反应生成乙醇;
②将乙醇与浓硫酸共热至170℃来制取乙烯;
③实验室用电石和水制取乙炔;
④苯和浓溴水不反应,和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯;
⑤将乙醇和浓硫酸按体积比1:3混和共热至170℃制乙烯.
解答 解:①溴乙烷和NaOH的水溶液发生水解反应生成乙醇,溴乙烷和水不反应,所以不能实现实验目的,故错误;
②将乙醇与浓硫酸共热至170℃来制取乙烯,加热140℃得到乙醚,故错误;
③电石的主要成分是碳化钙,碳化钙和水反应生成氢氧化钙和乙炔,所以实验室用电石和水制取乙炔,故正确;
④苯和浓溴水不反应,和液溴在溴化铁作催化剂条件下发生取代反应生成溴苯,所以不能实现实验目的,故错误;
⑤将乙醇和浓硫酸按体积比1:3混和共热至170℃制乙烯,浓硫酸作催化剂,稀硫酸没有催化作用,故错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、实验操作等知识点,明确实验原理、物质性质、实验条件等知识点是解本题关键,注意实验室制取乙烯时温度计位置及加热温度,为易错点.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②④不可以 | D. | 仅③可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )| A. | 常温下,1mol丁香酚只能与1mol Br2发生反应 | |
| B. | 香兰素分子中至少有12个原子共平面 | |
| C. | 1mol香兰素最多能与3mol氢气发生加成反应 | |
| D. | 丁香酚不能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(H2)=0.1 mol•L-1•S-1? | B. | V(N2)=0.2 mol•L-1•S-1? | ||
| C. | V(NH3)=0.15 mol•L-1•S-1? | D. | V(H2)=18 mol•L-1•min-1? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•s-1,0.4 mol | B. | 0.2 mol•L-1•s-1,0.4 mol | ||
| C. | 0.2 mol•L-1•s-1,0.6 mol | D. | 0.4 mol•L-1•s-1,0.12 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
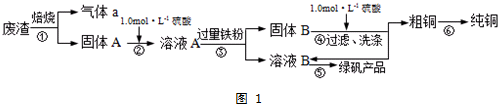
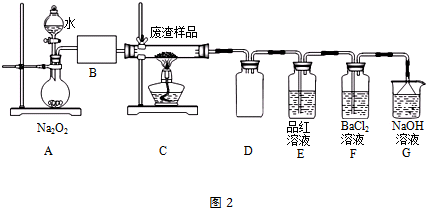
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com