
| 1 |
| 2 |
| 1 |
| 2 |
 ,;
,; ;
;

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
| A、H2O |
| B、CO2 |
| C、KHSO4固体 |
| D、KOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、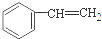 没有顺反异构体 没有顺反异构体 |
| B、1,3-丁二烯可以作为合成高分子化合物的原料 |
| C、用乙醇和浓硫酸制备乙烯时,用水浴加热控制反应温度 |
| D、常温下,将苯酚加入到少量水中有浑浊,滴入适量NaOH溶液后浑浊消失 |
E、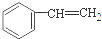 |
查看答案和解析>>
科目:高中化学 来源: 题型:
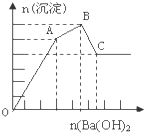 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如图所示.沉淀的生成与溶解的pH列于下表.以下推断错误的是( ) | 氢氧化物 | 溶液PH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)2 | 2.3 | 3.4 | - | - |
| Al(OH)2 | 3.3 | 5.2 | 7.8 | 12.8 |
| A、C点的沉淀为:Fe(OH)3和 BaSO4 |
| B、OA段可能发生的反应有:3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ |
| C、AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-→2BaSO4↓+Al(OH)3↓ |
| D、据图计算原溶液中c(Cl-)=c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.21mol |
| B、0.25mol |
| C、0.45mol |
| D、0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥ | B、①②③ |
| C、④⑤⑥ | D、①④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com