
| A. | 标准状况下,11.2 L SO3中含有0.5NA个SO3分子 | |
| B. | 48g O3气体含有3NA个氧原子 | |
| C. | 在1L0.5mol•L-lFeCl3溶液中含有0.5NA个Fe3+ | |
| D. | 1.5 mol NO2与足量水反应,转移的电子数为1.5NA |
分析 A、标况下三氧化硫为固体;
B、臭氧由氧原子构成;
C、铁离子为弱碱阳离子;
D、二氧化氮与水的反应为歧化反应.
解答 解:A、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、臭氧由氧原子构成,故48g臭氧中含有的氧原子的物质的量为n=$\frac{48g}{16g/mol}$=3mol,即3NA个,故B正确;
C、铁离子为弱碱阳离子,在溶液中会水解,故溶液中的铁离子的个数小于0.5NA个,故C错误;
D、二氧化氮与水的反应为歧化反应,3mol二氧化氮转移2mol电子,故1.5mol二氧化氮转移1mol电子即NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件只能是加入催化剂 | |
| B. | 反应达到平衡时外界条件对平衡影响关系如图B所示,则正反应为放热反应,且a>b | |
| C. | 物质的量和温度关系如图C所示,则该反应的正反应为放热反应 | |
| D. | 反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
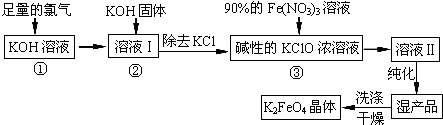
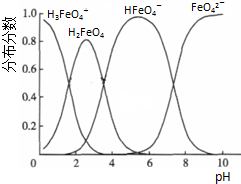
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 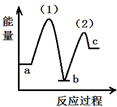 | B. | 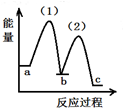 | C. | 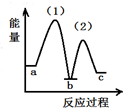 | D. | 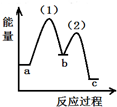 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
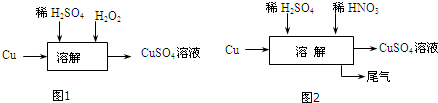
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
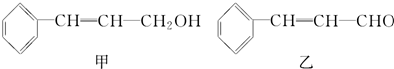
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
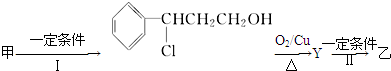
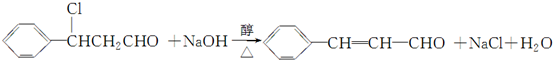 (注明反应条件).
(注明反应条件).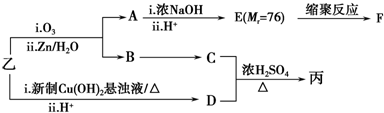
 .
.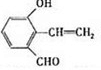 .
.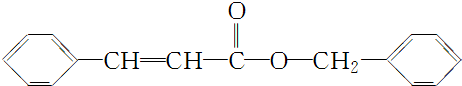 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应,熵增加 | B. | 放热反应,熵减小 | C. | 吸热反应,熵增加 | D. | 吸热反应,熵减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加少量硫酸铜溶液 | B. | 不用铁片,改用铁粉 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com