
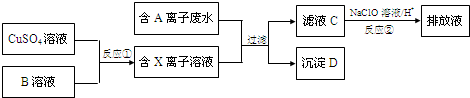
���� 9.0g����D�����������պ���8.0g��ɫ���壬��ɫ����ӦΪCuO�����ɵ�����ͨ����������ʯ��ˮʱ������10.0g��ɫ��������ɫ����ΪCaCO3�������ʵ���Ϊ$\frac{10g}{100g/mol}$=0.1mol��̼Ԫ������Ϊ0.1mol��12g/mol=1.2g�����������ʵ���Ϊ$\frac{1.12L}{22.4L/mol}$=0.05mol��CuO�����ʵ���Ϊ$\frac{8g}{80g/mol}$=0.1mol��C��N��CuԪ��������Ϊ1.2g+1.4g+0.1mol��64g/mol=9g�����ڳ���D����������D��Cu��C��N����Ԫ����ɣ�����ԭ�����ʵ���֮��Ϊ0.1mol��0.1mol��0.05mol��2=1��1��1����D�Ļ�ѧʽΪCuCN��A����ΪCN-���ӡ�XΪCu+���ӣ�BӦΪ���л�ԭ�Ե����ʣ�CN-������NaClO����������ת��Ϊ�Ի����������ʣ�Ӧ�����ɵ�����������̼�������Ȼ�����ˮ���ɣ�Na2SO3���л�ԭ�ԣ��п��ܽ�Cu2+��ԭΪCu+���ӣ�Na2SO3��Һ����Ϊ����Na2SO4�����������Ȼ�����Һ������Һ���Ƿ����������ע����������ų�����������ӵ�Ӱ�죬�Դ˽����⣬
��1��������֪D�Ļ�ѧʽΪCuCN��
��2������D��������������������ͭ�������Ͷ�����̼�����ԭ���غ���ƽ��д��ѧ����ʽ��
��3��CN-������NaClO����������ת��Ϊ�Ի����������ʣ�Ӧ�����ɵ�����������̼�������Ȼ�����ˮ���ɣ�
��4��Na2SO3���л�ԭ�ԣ��п��ܽ�Cu2+��ԭΪCu+���ӣ�
Na2SO3��Һ����Ϊ����Na2SO4�����������Ȼ�����Һ������Һ���Ƿ����������ע����������ų�����������ӵ�Ӱ�죮
��� �⣺��1������D�Ļ�ѧʽ�ǣ�CuCN���ʴ�Ϊ��CuCN��
��2������D�����������շ����Ļ�ѧ����ʽ��2CuCN+3O2$\frac{\underline{\;\;��\;\;}}{\;}$2CuO+N2+2CO2��
�ʴ�Ϊ��2CuCN+3O2$\frac{\underline{\;\;��\;\;}}{\;}$2CuO+N2+2CO2��
��3��CN-������NaClO����������ת��Ϊ�Ի����������ʣ�Ӧ�����ɵ�����������̼�������Ȼ�����ˮ���ɣ���Ӧ���ӷ���ʽΪ��2CN-+5ClO-+2H+=5Cl-+N2��+2CO2��+H2O��
�ʴ�Ϊ��2CN-+5ClO-+2H+=5Cl-+N2��+2CO2��+H2O��
��4��Na2SO3���л�ԭ�ԣ��п��ܽ�Cu2+��ԭΪCu+���ӣ�������Na2SO3��Һ������B��Һ��
Na2SO3��Һ����Ϊ����Na2SO4������Na2SO3��Һ�Ƿ���ʵķ���Ϊ��ȡ����Na2SO3��Һ���Թ��У���������ϡ���ᣬ�ټ����Ȼ�����Һ�����г������ɣ�˵��Na2SO3��Һ���ʣ�����˵��Na2SO3��Һδ���ʣ�
�ʴ�Ϊ�����ԣ���ΪNa2SO3���л�ԭ�ԣ��п��ܽ�Cu2+��ԭΪCu+���ӣ�ȡ����Na2SO3��Һ���Թ��У���������ϡ���ᣬ�ټ����Ȼ�����Һ�����г������ɣ�˵��Na2SO3��Һ���ʣ�����˵��Na2SO3��Һδ���ʣ�
���� ���⿼�������ƶϡ�������ԭ��Ӧ��ʵ�鷽����Ƶȣ����ڼ���²���֤�ͣ����ؿ���ѧ����ѧ������������Ҫѧ���߱���ʵ�Ļ�������Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | E��N��M��P | B�� | M��N��P��E | C�� | P��M��N��E | D�� | P��N��M��E |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Թܼм��Թ�Ӧ���Թܵ������ף�Ĵָ�����ԹܼеĶ̱��� | |
| B�� | װ����Լ�ƿ�в����ĵ�����þƾ�ϴ�� | |
| C�� | ������Һʱ�����������Һ�壬����Ͳ��ȡ������ֱ�ӵ�������ƿ�У�������������ˮ���ӽ��̶���1��2 cm�����õιܵμ�����ˮ���̶��� | |
| D�� | ����ʱ�����ӿ̶��ߣ���ʹ������Һ��Ũ��ƫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ĺ��������ǻ���-OH�� | B�� | �ӵĹ��������ǻ���-OH�� | ||
| C�� | ȩ�Ĺ�������ȩ����-CHO�� | D�� | ����Ĺ��������ǻ���-OH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ȼ����Ϊ��H=-890.3 kJ•mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4��g��+2O2��g���TCO2��g��+2H2O��g����H=-890.3 kJ•mol-1 | |
| B�� | ��֪H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ•mol-1����ϡH2SO4��Һ��ϡBa��OH��2��Һ��Ӧ�ķ�Ӧ�ȡ�H�T2����-57.3��kJ•mol-1 | |
| C�� | Mg��CO2��ȼ������MgO��C���÷�Ӧ�л�ѧ��ȫ��ת��Ϊ���� | |
| D�� | �����£���ӦC��s��+CO2��g���T2CO��g�������Է����У���÷�Ӧ�ġ�H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ͼʾΪһ����Ȼ�������һ���ij��ݹ�Ч�������йظû������˵����ȷ���ǣ�������
ͼʾΪһ����Ȼ�������һ���ij��ݹ�Ч�������йظû������˵����ȷ���ǣ�������| A�� | �����к������ֹ����� | |
| B�� | 1 mol �û������������6 mol NaOH ��Ӧ | |
| C�� | �ȿ��Է���ȡ����Ӧ�����ܹ������ӳɷ�Ӧ | |
| D�� | ������FeCl3������ɫ��Ӧ��Ҳ�ܺ�NaHCO3��Ӧ�ų�CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | �¶�/�� | SO2/mol | O2/mol | ���� |
| A | 400 | 4 | 2 | �� |
| B | 400 | 2 | 1 | �� |
| C | 500 | 2 | 1 | �� |
| D | 500 | 4 | 2 | �� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com