
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 有机物A的分子式为C4H10O3,1molA与足量钠反应放出1mol氢气,说明该分子中含有3个醇羟基,且1个碳原子上不能连接2个羟基,三元取代物的同分异构体可以采用“定一议二”法解题.
解答 解:有机物A的分子式为C4H10O3,1molA与足量钠反应放出1.5mol氢气,说明该分子中含有3个醇羟基,且1个碳原子上不能连接2个羟基,C4H10(OH)3的同分异构体可以采取“定一议二”法确定:碳链为C1-C2-C3-C4时,1位定-OH,另外2个羟基可以放在2、3,2、4,有2种结构;当烃为异丁烷时,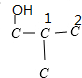 3个甲基等效,3个-OH分别放在不同甲基上有一种结构,有一个-OH放在1位,2个-OH分别放在甲基上,有1种结构,故结构共有2+1+1=4种,故选B.
3个甲基等效,3个-OH分别放在不同甲基上有一种结构,有一个-OH放在1位,2个-OH分别放在甲基上,有1种结构,故结构共有2+1+1=4种,故选B.
点评 本题考查有机物同分异构体种类的确定,官能团已经确定,且不考虑立体异构,则只能是碳链异构,根据碳链异构分析解答即可,难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
| A. | 单质的还原性:G<L<M | B. | 非金属性:T<Q | ||
| C. | 气态氢化物的稳定性:R>T | D. | L2+与T2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 8种 | C. | 10种 | D. | 16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国自行研制的航母中使用到了大量特种钢,钢属于合金 | |
| B. | 珠三角是酸雨重灾区,酸雨主要成分是硝酸和碳酸 | |
| C. | 碘是人体必需微量元素,食盐加碘加的就是碘单质 | |
| D. | 节日里五颜六色的焰火利用的是金属单质的焰色反应,焰色反应属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油的主要成分是烃,石油经过分馏可制得汽油、乙烯等产品 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某元素的一种核素的核内质子数为m,中子数为n,由此一定能确定该元素的近似相对原子质量为m+n | |
| B. | 短周期元素X、Y、Z,X的阳离子与Y的阴离子具有相同的电子层结构,Z的阴离子的还原性大于等电荷数Y的阴离子的还原性,那么原子序数大小是Z>X>Y | |
| C. | 第118元素在元素周期表中的位置是第七周期VIA族 | |
| D. | 碱金属单质的熔沸点和卤素单质的熔沸点都是随核电荷数的递增而升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com